题目内容
13.回答下列问题:(1)CO2气体中混有SO2,除去SO2的实验方法是用饱和碳酸氢钠溶液洗气.
(2)欲配制100mL 浓度约为0.1mol•L-1的NH4Al(SO4)2溶液,用托盘天平称量NH4Al(SO4)2•12H2O固体4.5g
(3)工业上用电解饱和食盐水的方法生产氯气和烧碱.某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理为Cl2+2OH-=Cl-+ClO-+H2O(用离子方程式表示).
(4)碱式碳酸铜可表示为:xCuCO3•yCu(OH)2•zH2O,测定碱式碳酸铜组成的方法有多种.现采用氢气还原法,请回答如下问题:
写出xCuCO3•yCu(OH)2•zH2O与氢气反应的化学方程式xCuCO3•yCu(OH)2•zH2O+(x+y)H2$\frac{\underline{\;\;△\;\;}}{\;}$(x+y)Cu+xCO2+(x+2y+z)H2O,称取23.9克某碱式碳酸铜样品,充分反应后得到12.7克残留物,生成4.4克二氧化碳和7.2克水.该样品的结晶水质量为1.8 克,化学式为CuCO3•Cu(OH)2•H2O.
分析 (1)可用饱和碳酸氢钠溶液除去二氧化硫;
(2)根据n=cV计算溶质的物质的量,结合m=nM计算溶质的质量;
(3)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(4)根据CuCO3受热分解得到CuO和CO2、Cu(OH)2受热分解得到CuO和H2O,然后氢气与CuO反应生成水,所以xCuCO3•yCu(OH)2•zH2O与氢气反应的产物有:Cu、CO2、H2O,根据反应xCuCO3•yCu(OH)2•zH2O$\frac{\underline{\;\;△\;\;}}{\;}$(x+y)CuO+xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成.
解答 解:(1)二氧化硫与碳酸氢钠反应生成二氧化碳,二氧化碳与饱和碳酸氢钠溶液不反应,则可用饱和碳酸氢钠溶液除去二氧化硫,
故答案为:用饱和碳酸氢钠溶液洗气;
(2)n(NH4Al(SO4)2)=0.1L×0.1mol/L=0.01mol,m(NH4Al(SO4)2•12H2O)=0.01mol×453g/mol=4.53g,可用托盘天平称量4.5g
故答案为:4.5;
(3)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)xCuCO3•yCu(OH)2•zH2O与氢气反应的产物有:Cu、CO2、H2O,方程式为:xCuCO3•yCu(OH)2•zH2O+(x+y)H2$\frac{\underline{\;\;△\;\;}}{\;}$(x+y)Cu+xCO2+(x+2y+z)H2O,
xCuCO3•yCu(OH)2•zH2O+( x+y)H2$\frac{\underline{\;\;△\;\;}}{\;}$(x+y)Cu+xCO2↑+(x+2y+z)H2O
64(x+y) 44x 18(x+2y+z)
12.7g 4.4g 7.2g
$\frac{64(x+y)}{12.7}$=$\frac{44}{4.4}$
解得:y=x
$\frac{44}{4.4}$=$\frac{18(x+2y+z)}{7.2}$,
解得:z=x
令x=1,则y=1,z=1,则化学式为CuCO3•Cu(OH)2•H2O,化学方程式为CuCO3•Cu(OH)2•H2O+2H2=2Cu+CO2↑+4H2O,由化学方程式可以看出,碱式碳酸铜每1个水分子能生成4个水分子,即生成的水中碱式碳酸铜中水占了$\frac{1}{4}$,因此碱式碳酸铜中水的质量为:7.2g×$\frac{1}{4}$=1.8g,
故答案为:xCuCO3•yCu(OH)2•zH2O+(x+y)H2=(x+y)Cu+xCO2+(x+2y+z)H2O;1.8g;CuCO3•Cu(OH)2•H2O.
点评 本题考查较为综合,侧重于学生的分析能力、计算能力以及实验能力的考查,注意把握物质的性质,从质量守恒的角度计算,难度中等.

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案| A. | 合成氨反应中,断开1molN≡N键,同时生成6molN-H键,达化学平衡状态 | |
| B. | 有气体参与的可逆反应中,当反应容器中的压强保持不变时,达到化学平衡状态 | |
| C. | 当反应物或生成物在混合物中的百分含量保持不变时,即达到化学平衡状态 | |
| D. | 工业生产中采用高温是因为高温下反应物的转化率比低温时高 |
| A. | 要使AlCl3溶液中Al3+全部沉淀出来可使用氨水 | |
| B. | 要检验某溶液中是否含Fe3+可加入铁粉 | |
| C. | 新制的氯水中加入锌粒可检验其中含H+ | |
| D. | 某气体能使品红溶液褪色,该气体一定为SO2 |
| A. | 氧化铝是冶炼金属铝的原料,由于它熔点高,也是一种较好的耐火材料 | |
| B. | 在混有少量泥沙浑浊水两只试管分别加入少量明矾、硫酸铁溶液,水变得清澈 | |
| C. | 纯净的SiO2是现代光学及光纤制品的基本原料,也是人类将太阳能转化电能的常用材料 | |
| D. | 酸雨是由大气中SO2、NO2溶于雨水形成的 |
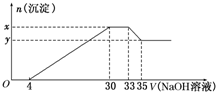 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如右图所示.下列叙述不正确的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如右图所示.下列叙述不正确的是( )| A. | 原溶液中c(H+)=0.1mol/L | B. | x与y的差值为0.01 mol | ||
| C. | 原溶液中c(Cl-)=0.75 mol/L | D. | 原溶液中n(Mg2+):n(Al3+)=5:1 |
| 选项 | 有机物 | 同分异构体数目 |
| A | 戊烷 | 2种 |
| B | C8H10中属于芳香烃的有机物 | 3种 |
| C | 分子式为C5H10O2且能与NaHCO3反应生成CO2的有机物 | 4种 |
| D | C4H8的链状化合物 | 4种 |
| A. | A | B. | B | C. | C | D. | D |
| A. | X一定只由CO组成 | |
| B. | X一定只由H2和CO2组成 | |
| C. | X可能由0.1 g H2和4.4 g CO2组成 | |
| D. | X可能由0.1 g H2、1.4 g CO和2.2 g CO2组成 |