题目内容
3.537℃,1.01×105Pa时,往容积可变的密闭容器中充入2molSO2,lmolO2,向容器中加入催化剂(固体)并保持恒温恒压,发生反应:2SO2(g)+O2(g)?2SO3(g)达到平衡时,平衡气体中SO3的体积分数为0.91,容器的体积为200L.保持上述温度和压强不变,若向容器中只充入2molSO3并加入固体催化剂,则平衡时,SO2的体积分数是6%,容器的体积为137.3L.分析 (1)达到平衡时,平衡气体中SO3的体积分数为0.91,
2SO2(g)+O2(g)?2SO3(g),
开始 2 1 0
转化 2x x 2x
平衡2-2x 1-x 2x
则$\frac{2x}{3-x}$=0.91,解得x=0.94,
保持上述温度和压强不变,若向容器中充入2mol SO3,与充入2molSO2、1molO2,达到平衡时状态相同,物质的量与压强成正比.
解答 解:(1)达到平衡时,平衡气体中SO3的体积分数为0.91,
2SO2(g)+O2(g)?2SO3(g),
开始 2 1 0
转化 2x x 2x
平衡2-2x 1-x 2x
则$\frac{2x}{3-x}$=0.91,解得x=0.94,
则平衡时,SO2的体积分数是(1-0.91)×$\frac{2}{3}$×100%=6%,
保持上述温度和压强不变,平衡时气体的总的物质的量为3mol-0.94mol=2.06mol,所以平衡时气体的总体积为V=$\frac{2.06}{3}$=137.3L,
故答案为:6%;137.3.
点评 本题考查化学平衡的计算及等效平衡,注意把握温度、体积、压强的条件,判断两种状态为等同的平衡状态是解答的关键,题目难度中等.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
14.生活中处处离不开化学.下列说法中,错误的是( )
| A. | 食用蔬菜、水果可补充维生素 | |
| B. | 适当补充钙元素可以预防甲状腺肿大 | |
| C. | 熟石灰可用于改良酸性土壤 | |
| D. | 生活污水处理后排放有利于保护环境 |
18.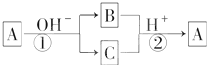 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列判断正确的是( )
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列判断正确的是( )
 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列判断正确的是( )
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列判断正确的是( )| A. | X元素可能为Al | B. | X元素可能为Si | ||
| C. | 反应①和②互为可逆反应 | D. | 反应①和②一定为氧化还原反应 |
15.下列说法正确的是( )
| A. | 按系统命名法,化合物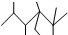 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等 | |
| C. | 苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 结构片段 的高聚物是由加聚反应形成,其单体分子式为C7H60 的高聚物是由加聚反应形成,其单体分子式为C7H60 |
12.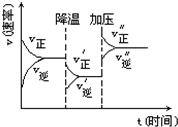 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 若A、B是气体,则D是液体或固体 | B. | A、B、C、D均为气体 | ||
| C. | 逆反应是放热反应 | D. | 达平衡后,v(A)正=2 v(C)逆 |
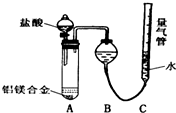 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究.填写下列空白. 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下: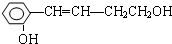 它能发生的反应是( )
它能发生的反应是( )