题目内容
8.下列有关物质的性质描述不符合事实的是( )| A. | 氧化铝是冶炼金属铝的原料,由于它熔点高,也是一种较好的耐火材料 | |
| B. | 在混有少量泥沙浑浊水两只试管分别加入少量明矾、硫酸铁溶液,水变得清澈 | |
| C. | 纯净的SiO2是现代光学及光纤制品的基本原料,也是人类将太阳能转化电能的常用材料 | |
| D. | 酸雨是由大气中SO2、NO2溶于雨水形成的 |
分析 A、电解氧化铝得到金属铝,氧化铝熔点高;
B、铝盐、铁盐溶于水电离出的Al3+和Fe3+能水解出Al(OH)3和Fe(OH)3胶体;
C、二氧化硅是现代光学及光纤制品的基本原料,将太阳能转化电能的是硅晶体;
D、酸雨的形成有硫酸型酸雨、硝酸型酸雨;
解答 解:A、电解氧化铝得到金属铝,氧化铝熔点高,氧化铝是冶炼金属铝的原料,也是一种比较好的耐火材料,故A正确;
B、明矾属于铝盐、硫酸铁属于铁盐溶于水电离出的Al3+和Fe3+能水解出Al(OH)3和Fe(OH)3胶体,能吸附水中的杂质,故能起到净水的作用,水变得清澈,故B正确;
C、将太阳能转化电能的是硅晶体,现代光学及光纤制品的主要原料为二氧化硅,故C错误;
D、酸雨的形成有硫酸型酸雨、硝酸型酸雨,是由大气中SO2、NO2溶于雨水形成酸形成的,故D正确;
故选C.
点评 本题考查了物质性质的分析判断,主要是盐类水解分析物质用途和物质制备的应用,掌握基础是解题关键,题目较简单.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目
18.在约100℃的温度下,NaCl稀溶液中[H+]为1×10-6 mol•L-1.下列说法中正确的是( )
| A. | 该NaCl溶液显酸性 | |
| B. | 该NaCl溶液显中性 | |
| C. | 该NaCl溶液中KW=1×10-14 mol2•L-2 | |
| D. | 该NaCl溶液中KW=1×10-12 mol2•L-2 |
3.下列说法不正确的是( )
| A. | 氯气、二氧化氯、臭氧都可用于自来水的消毒 | |
| B. | 氯水、漂白液、漂白粉的溶液都能是有色布条褪色 | |
| C. | 某溶液加入硝酸银溶液产生白色沉淀,加入盐酸沉淀不消失,该溶液一定含Cl- | |
| D. | 氯气在化学工业中可用来制取高纯度的硅、锗、钛 |
17.V L Fe2(SO4)3溶液中,含有Fe3+ m g,则溶液中SO42-的物质的量浓度为( )
| A. | $\frac{56m}{V}$mol•L-1 | B. | $\frac{3m}{56V}$mol•L-1 | C. | $\frac{m}{56V}$mol•L-1 | D. | $\frac{3m}{112V}$mol•L-1 |
18.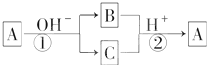 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列判断正确的是( )
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列判断正确的是( )
 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列判断正确的是( )
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列判断正确的是( )| A. | X元素可能为Al | B. | X元素可能为Si | ||
| C. | 反应①和②互为可逆反应 | D. | 反应①和②一定为氧化还原反应 |
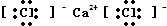 _ CC14
_ CC14 _ HC1O
_ HC1O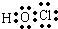 OH-
OH-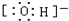
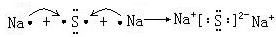 .
. .
.