题目内容
18.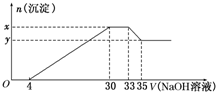 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如右图所示.下列叙述不正确的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如右图所示.下列叙述不正确的是( )| A. | 原溶液中c(H+)=0.1mol/L | B. | x与y的差值为0.01 mol | ||
| C. | 原溶液中c(Cl-)=0.75 mol/L | D. | 原溶液中n(Mg2+):n(Al3+)=5:1 |
分析 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的NaOH溶液,加入4mLNaOH溶液时没有沉淀生成,说明H+先和NaOH反应,则溶液中含有H+,c(H+)=$\frac{0.004L×5mol/L}{0.2L}$=0.1mol/L,继续滴加NaOH溶液,沉淀的量逐渐增大,30mLNaOH溶液后,继续滴加NaOH溶液,沉淀的物质的量不变,则溶液中含有NH4+,则C(NH4+)=$\frac{(0.033-0.03)L×5mol/L}{0.2L}$=0.075mol/L,继续滴加NaOH,沉淀溶解,35mLNaOH后,沉淀不溶解,说明溶液中含有Mg2+、Al3+,根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,生成氢氧化铝沉淀和生成偏铝酸根离子需要氢氧化钠体积之比为3:1,则生成氢氧化铝沉淀需要NaOH体积=(35-33)mL×3=6mL,则生成氢氧化镁需要NaOH体积=(30-4mL)-6mL=20mL,
则c(Mg2+)=$\frac{\frac{0.02L×5mol/L}{2}}{0.2L}$=0.25mol/L,c(Al3+)=$\frac{0.002L×5mol/L}{0.2L}$=0.05mol/L,
溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Mg2+)+C(NH4+)+c(H+)=c(Cl-)=[3×0.05+2×0.25+0.075+0.1]mol/L=0.825mol/L,据此分析解答
解答 解:在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的NaOH溶液,加入4mLNaOH溶液时没有沉淀生成,说明H+先和NaOH反应,则溶液中含有H+,c(H+)=$\frac{0.004L×5mol/L}{0.2L}$=0.1mol/L,继续滴加NaOH溶液,沉淀的量逐渐增大,30mLNaOH溶液后,继续滴加NaOH溶液,沉淀的物质的量不变,则溶液中含有NH4+,则C(NH4+)=$\frac{(0.033-0.03)L×5mol/L}{0.2L}$=0.075mol/L,继续滴加NaOH,沉淀溶解,35mLNaOH后,沉淀不溶解,说明溶液中含有Mg2+、Al3+,根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,生成氢氧化铝沉淀和生成偏铝酸根离子需要氢氧化钠体积之比为3:1,则生成氢氧化铝沉淀需要NaOH体积=(35-33)mL×3=6mL,则生成氢氧化镁需要NaOH体积=(30-4mL)-6mL=20mL,
则c(Mg2+)=$\frac{\frac{0.02L×5mol/L}{2}}{0.2L}$=0.25mol/L,c(Al3+)=$\frac{0.002L×5mol/L}{0.2L}$=0.05mol/L,
溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Mg2+)+C(NH4+)+c(H+)=c(Cl-)=[3×0.05+2×0.25+0.075+0.1]mol/L=0.825mol/L,
A.通过分析知,c(H+)=0.1mol/L,故A正确;
B.x为Al(OH)3、Mg(OH)2的物质的量,y为Mg(OH)2的物质的量,二者的差为Al(OH)3的物质的量=0.05mol/L×0.2L=0.01mol,故B正确;
C.原来溶液中c(Cl-)=0.825mol/L,故C错误;
D.通过以上分析知,c(Mg2+)=0.25mol/L,c(Al3+)=0.05mol/L,同一溶液中体积相等,其物质的量之比等于物质的量浓度之比=0.25mol/L:0.05mol/L=5:1,故D正确;
故选C.
点评 本题考查物质之间的反应,明确离子反应先后顺序是解本题关键,知道铝离子转化为氢氧化铝沉淀、偏铝酸钠时消耗NaOH的体积之比,结合电荷守恒解答,题目难度中等.

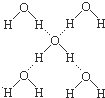 下列有关冰的说法中,正确的组合是( )
下列有关冰的说法中,正确的组合是( )①水分子间既有氢键又有范德华力;
②每个水分子处在另外四个水分子所围成的四面体中;
③每个O原子处在四个H原子所围成的四面体中;
④冰的结构是由氢键的方向性和饱和性所决定的;
⑤冰中H和O原子之间的作用力不是σ键就是氢键
⑥每个水分子平均拥有四个氢键.
| A. | 除⑥外 | B. | 除④外 | C. | 除④⑤⑥外 | D. | 全对 |
| A. | 2.5 mol | B. | 2 mol | C. | 1.25 mol | D. | 0.5 mol |
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 常温时水溶性碱性:Na2CO3>NaHCO3 | |
| C. | 等质量的Na2CO3与NaHCO3与过量稀盐酸反应产生的CO2:Na2CO3>NaHCO3 | |
| D. | Na2CO3溶液能与Ca(OH)2溶液反应,而NaHCO3溶液不能与Ca(OH)2溶液反应 |
①配制480mL0.1mol/L氢氧化钠溶液用500mL的容量瓶;
②用托盘天平称取5.85gNaCl固体;
③中和滴定操作时,消耗0.1000mol/L的盐酸23.0mL;
④用广泛pH试纸测得血液的pH=7.4;
⑤实验室用乙醇制乙烯时,为更好控制温度选择水浴加热法.
| A. | 只有①正确 | B. | 只有②错误 | C. | ①③④正确 | D. | ①②③④⑤全错 |
| A. | 将等物质的量的甲烷与氯气充分反应生成物中物质的量最大的是CH3Cl | |
| B. | 苯乙烯生成乙基环己烷不属于取代反应 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 煤的干馏、石油裂化和乙烯聚合均属于化学变化 |
| A. | 3种 | B. | 8种 | C. | 10种 | D. | 12种 |
 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下: