题目内容
1.在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质,铜粉溶解的是( )①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3.
| A. | 只有①或② | B. | 只有②或④ | C. | 只有①或②或③ | D. | ①②③④中任意一种 |
分析 根据铜的化学性质判断,如:铜不能与弱氧化性酸反应,但可以和强氧化性酸反应,能与具有氧化性的FeCl3溶液、酸性条件下的硝酸盐等反应.
解答 解:①铜能和氯化铁反应生成氯化亚铁和氯化铜,所以铜能在氯化铁溶液中溶解,故正确;
②因Fe2O3能与稀硫酸反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Fe2(SO4)3能与铜粉反应:Fe2(SO4)3+Cu=2FeSO4+CuSO4,所以铜粉溶解,故正确;
③向稀硫酸反应加入硝酸铜后,溶液中含有氢离子和硝酸根离子,所以相当于溶液中含有硝酸,硝酸能和铜反应,3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,所以加入硝酸铜后能溶解铜,故正确;
④依据③的分析可知,加入硝酸钾,相当于加入硝酸根,也与硫酸中的氢离子构成硝酸致使铜溶解,故正确;
故选D.
点评 本题主要考查了金属铜的化学性质,对于铜和硝酸的反应要特别注意,可以直接加硝酸也可以分步产生:先加非氧化性酸(如盐酸、稀硫酸)后加硝酸盐,铜一样能被溶解.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.将纯锌片和纯铜片按如图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )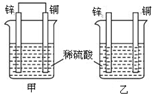

| A. | 甲烧杯中锌片逐渐溶解,乙烧杯中锌片不溶解 | |
| B. | 两烧杯中铜片表面均无气泡产生 | |
| C. | 两烧杯中溶液的酸性均减弱 | |
| D. | 甲烧杯中铜片上的电极反应为:Cu2++2e-=Cu |
12.下列气体的主要成分不是甲烷的是( )
| A. | 坑道气 | B. | 煤气 | C. | 天然气 | D. | 沼气 |
9.将N2和H2的混合气体分别充入甲、乙、丙三个容器中进行合成氨反应,经过一段时间后反应速率为:v甲(H2)=3mol•L-1•min-1,v乙(N2)=2mol•L-1•min-1,v丙(NH3)=1mol•L-1•min-1.这段时间内三个容器中合成氨的反应速率的大小关系为( )
| A. | v甲>v乙>v丙 | B. | v乙>v甲>v丙 | C. | v甲>v丙>v乙 | D. | v甲=v乙=v丙 |
6.下列物质中,在空气中能稳定存在的是( )
| A. | 亚硫酸 | B. | 氢硫酸 | C. | 碳酸钠溶液 | D. | 氢氧化钠溶液 |
13.属于氮的固定的是( )
| A. | 植物从土壤中吸收含氮养料 | |
| B. | 豆科植物把含氮化合物转变为蛋白质 | |
| C. | 将空气中的氮气转化为含氮化合物 | |
| D. | NH3经催化氧化生成NO |
10.下列物质中,不能通过单质间直接化合得到的是( )
| A. | FeCl3 | B. | CuS | C. | Na2O2 | D. | FeS |
2. 酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.
Ⅰ.实验前首先用浓度为0.1000mol/L酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)滴定过程中操作滴定管的图示正确的是A
(3)若配置酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度偏低(填“偏高”、“偏低”或“不变”)
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol/L.用该草酸按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
(4)写出表中a对应的实验目的探究温度不同对反应速率的影响;
(5)该小组同学对实验1和3分别进行的3次实验,测得以下实验数据(从混合振荡均匀开始计时)
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就缩短,即反应速率就越快”的结论.某同学认为该小组“探究反应物浓度对速率的影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案:其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示):2MnO4-+10Cl-+16H+=5Cl2↑+2Mn 2++8H2O.
 酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.Ⅰ.实验前首先用浓度为0.1000mol/L酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)滴定过程中操作滴定管的图示正确的是A
(3)若配置酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度偏低(填“偏高”、“偏低”或“不变”)
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol/L.用该草酸按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
| 实验 编号 | 温度 (℃) | 催化剂 用量(g) | 酸性KMnO4溶液 | 实验目的 a.实验1和2探究___________ b.实验1和3探究反应物浓度对该反应速率的影响 c.实验1和4探究催化剂对该反应速率的影响 | |
| 体积 (mL) | 浓度 (mol/L) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
(5)该小组同学对实验1和3分别进行的3次实验,测得以下实验数据(从混合振荡均匀开始计时)
| 实验 编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示):2MnO4-+10Cl-+16H+=5Cl2↑+2Mn 2++8H2O.
 甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.