题目内容
11.已知:①RNH2+R′CH2Cl$\stackrel{一定条件}{→}$RNHCH2R′+HCl(R和R′代表烃基)②苯的同系物能被高锰酸钾氧化,如:
 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$
③
 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ (苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
(苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
请回答下列问题:
(1)B物质的结构简式是
 .
.(2)写出反应①、②的化学方程式:
①
 ;
;②
 .
.(3)反应①~⑤中,属于取代反应的是①②⑤(填反应序号).
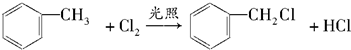
分析 甲苯在光照条件发生甲基上取代反应生成 ,由A系列反应得到
,由A系列反应得到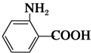 ,反应中引入-COOH、-NH2,且处于邻位,甲基氧化得到-COOH,由题目信息可知,-NO2还原得到-NH2,由于苯胺易被氧化,所以用KMnO4(H+)先氧化-CH3成-COOH,再将-NO2还原得到-NH2,故A转化得到B是甲苯的硝化反应,可知A为
,反应中引入-COOH、-NH2,且处于邻位,甲基氧化得到-COOH,由题目信息可知,-NO2还原得到-NH2,由于苯胺易被氧化,所以用KMnO4(H+)先氧化-CH3成-COOH,再将-NO2还原得到-NH2,故A转化得到B是甲苯的硝化反应,可知A为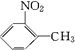 ,B为
,B为 ,
, 和
和 发生取代反应生成C,由信息(1)可知生成C为
发生取代反应生成C,由信息(1)可知生成C为 ,据此进行解答.
,据此进行解答.
解答 解:甲苯在光照条件发生甲基上取代反应生成 ,由A系列反应得到
,由A系列反应得到 ,反应中引入-COOH、-NH2,且处于邻位,甲基氧化得到-COOH,由题目信息可知,-NO2还原得到-NH2,由于苯胺易被氧化,所以用KMnO4(H+)先氧化-CH3成-COOH,再将-NO2还原得到-NH2,故A转化得到B是甲苯的硝化反应,可知A为
,反应中引入-COOH、-NH2,且处于邻位,甲基氧化得到-COOH,由题目信息可知,-NO2还原得到-NH2,由于苯胺易被氧化,所以用KMnO4(H+)先氧化-CH3成-COOH,再将-NO2还原得到-NH2,故A转化得到B是甲苯的硝化反应,可知A为 ,B为
,B为 ,
, 和
和 发生取代反应生成C,由信息(1)可知生成C为
发生取代反应生成C,由信息(1)可知生成C为 .
.
(1)B物质的结构简式是 ,故答案为:
,故答案为: ;
;
(2)反应①的化学方程式为: ;
;
反应②的化学方程式为: ,
,
故答案为: ;
; ;
;
(3)反应①~⑤中,①②⑤属于取代反应,反应③属于氧化反应,反应④属于还原反应,
故答案为:①②⑤.
点评 本题考查有机物的推断与合成,题目难度中等,根据题目信息结合有机物的结构判断发生的反应,进而推断其它物质的结构简式,明确常见有机反应概念及反应类型.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
2.构成下列四种物质的微粒间,既存在离子键又存在共价键的是( )
| A. | MgCl2 | B. | K2S | C. | NaOH | D. | SO3 |
6.下列说法或表示方法正确的( )
| A. | 已知C(s)+O2(g)═CO2(g)△H1;C(s)+$\frac{1}{2}$O2(g)═CO (g)△H2,则△H1>△H2 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热大于57.3 kJ | |
| C. | 由C(石墨)═C(金刚石);△H=+1.90kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 已知氢气的标准燃烧热为-285.8 kJ•mol-1,相应的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ•mol-1 |
16.在反应SO2+2H2S═3S+2H2O中,氧化产物与还原产物的物质的量之比为( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 3:1 |
3.下列事实与氢键有关的是( )
| A. | 水加热到很高温度都难以分解 | |
| B. | 氨易液化,氨极易溶于水 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
20.固体乙醇晶体中不存在的作用力是( )
| A. | 离子键 | B. | 氢键 | C. | 非极性键 | D. | 范德华力 |
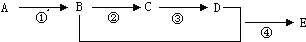
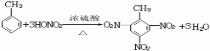 ,此反应属于取代反应,其生成物的名称是2.4.6-三硝基甲苯
,此反应属于取代反应,其生成物的名称是2.4.6-三硝基甲苯