题目内容
①(14分)A、B、C、D、E是周期表中短周期元素,它们的原子序数依次增大,A和D的最外层电子数是其电子层数的2倍,B和D同主族,C的原子是短周期元素中原子半径最大的。请回答:
(1)写出元素名称:A 、B 。
(2)已知AD2与AB2的结构相似,AD2的结构式为 ,
该分子是 (填“极性”或“非极性”)分子。
(3)常温下将E单质通入到C的最高价氧化物对应的水化物溶液里发生反应的离子方程
式为 。
(4)请写出B和C按原子个数比1∶1形成的化合物与A和B按按原子个数比1∶2形成的化合物反应的化学方程式,并标出电子转移的方向和数目 。
②(8分)下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
| Z |
|
|
|
| |||||||||||||
|
|
| M | L | Q | R |
|
| ||||||||||
| D | A |
|
| T | X | Y |
| ||||||||||
| E |
|
|
|
|
|
|
|
| J |
|
|
|
|
|
|
|
|
(1)Y分别与D、E形成的化合物中熔点较高是_________(用具体物质的化学式表示)。
(2)LY4分子的电子式是_____ ____。
(3)由J、L、R三种元素形成的某种配位化合物,常温下该化合物具有挥发性,化学式为J(LR)4,其中J的化合价是0价。J(LR)4固态时属于_________晶体(填晶体类型)。
(4)A与M组成的一种化合物AM2,刷新了金属化合物超导温度
的最高记录。下图中所示的是该化合物的晶体结构单元。图中
上、下底面中心“Δ”处的原子是_______(填元素符号)。
①(14分)(1)碳 氧(各2分) (2)![]() (2分) 非极性 (2分)
(2分) 非极性 (2分)
(3)![]() (3分)
(3分)
(4)略(3分)
②(8分,每空2分)(1)NaCl (2)略 (3)分子 (4) Mg
解析:略

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案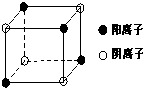 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.