题目内容
在下列反应中,HCl作还原剂的是( )
| A.2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O |
| B.Zn+2HCl=ZnCl2+H2↑ |
| C.NaOH+HCl=NaCl+H2O |
| D.CuO+2HCl=CuCl2+H2O |
A
解析试题分析:氯化氢作还原剂,氯化氢中的氢元素的化合价是最高价,所以氢元素不能再失去电子,故氯化氢中的氯元素失电子化合价升高,据此判断即可。A、MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑反应中,氯元素的化合价升高,氢元素的化合价不变,所以HCl是还原剂,故A正确;B、Zn+2HCl═ZnCl2+H2↑反应中,氯元素的化合价不变,氢元素的化合价降低,所以HCl是氧化剂,B错误;C、NaOH+HCl═NaCl+H2O反应中,氯元素化合价不变,所以HCl不是还原剂,故C错误;D、CuO+2HCl═CuCl2+H2O反应中,氯元素的化合价不变,氢元素的化合价不变,所以HCl不是还原剂,故D错误,答案选C。
MnCl2+2H2O+Cl2↑反应中,氯元素的化合价升高,氢元素的化合价不变,所以HCl是还原剂,故A正确;B、Zn+2HCl═ZnCl2+H2↑反应中,氯元素的化合价不变,氢元素的化合价降低,所以HCl是氧化剂,B错误;C、NaOH+HCl═NaCl+H2O反应中,氯元素化合价不变,所以HCl不是还原剂,故C错误;D、CuO+2HCl═CuCl2+H2O反应中,氯元素的化合价不变,氢元素的化合价不变,所以HCl不是还原剂,故D错误,答案选C。
考点:考查氧化还原反应的有关判断

 习题精选系列答案
习题精选系列答案下列进行性质比较的实验,不合理的是
| A.比较Cu、Fe的还原性:铜加入硫酸铁溶液中 |
| B.比较氯的非金属性强于溴:溴化钠溶液中通入氯气 |
| C.比较高锰酸钾的氧化性强于氯气:高锰酸钾中加入浓盐酸 |
| D.比较镁的金属性强于铝:取一小段去氧化膜的镁带和铝片,分别加入1.0 mol·L-1的盐酸中 |
Na2FeO4是一种高效多功能水处理剂,既能消毒杀菌,又能除去悬浮物杂质。一种制备Na2FeO4的反应原理为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列有关说法正确的是 ( )
| A.反应中氧化剂是Na2O2,还原剂是FeSO4 |
| B.生成2 mol Na2FeO4时,反应中共有8 mol电子转移 |
| C.Na2FeO4的氧化性大于Na2O2 |
| D.Na2FeO4净水过程中,既有氧化还原反应发生,又有非氧化还原反应发生 |
一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3的物质的量之比为3:5,则参加反应的Cl2与NaOH的物质的量之比为( )
| A.8:11 | B.3:5 | C.1:2 | D.9:4 |
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下: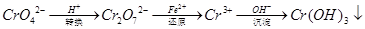
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到达平衡状态 |
| B.若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D.常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5 |
根据表中信息,判断下列叙述中正确的是
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | | Cl- |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较: KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为:2MnO4-+ 3H2O2 + 6H+=2Mn2+ + 4O2↑+ 6H2O
24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为 ( )。
| A.+2 | B.+3 | C.+4 | D.+5 |
铬是人体必需的微量元素,但铬过量会引起污染,危害人体健康。不同
价态的铬毒性不一样,六价铬的毒性最大。下列叙述错误的是( )
| A.K2Cr2O7可以氧化乙醇,可用来鉴别司机是否酒后驾驶 |
| B.污水中铬一般以Cr3+存在,与水中的溶解氧作用可被还原为六价铬 |
| C.人体内六价铬超标,服用维生素C缓解毒性,说明维生素C具有还原性 |
| D.1 mol Cr2O72—得到6 mol电子时,还原产物是Cr3+ |