题目内容
根据表中信息,判断下列叙述中正确的是
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | | Cl- |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较: KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为:2MnO4-+ 3H2O2 + 6H+=2Mn2+ + 4O2↑+ 6H2O
A
解析试题分析:A项中,物质的氧化性是Cl2>Br2>Fe3+,故Cl2先氧化Fe2+,再有多余的氧化Br-,故①组的反应可能有一种或两种元素被氧化,正确;B项中,氧化性是 KClO3>Cl2>Br2>Fe3+,不正确;C项中,②组反应中KClO3的还原产物是Cl2,化合价不交叉,电子转移数目是5e-,不正确;D项中,③组反应H2O2为还原剂,其中的O原子全部变成O2,应为2MnO4-+ 5H2O2 + 6H+=2Mn2+ + 5O2↑+ 8H2O。
考点:氧化还原反应的概念及电子转移。

 阅读快车系列答案
阅读快车系列答案在下列反应中,HCl作还原剂的是( )
| A.2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O |
| B.Zn+2HCl=ZnCl2+H2↑ |
| C.NaOH+HCl=NaCl+H2O |
| D.CuO+2HCl=CuCl2+H2O |
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可产生它。下列有关叙述中错误的是
| A.这“某物质”具有还原性 |
| B.CuH与盐酸反应,可能产生H2 |
| C.CuH与足量的稀硝酸反应:CuH + 3H+ + NO3—= Cu2++ NO↑+ 2H2O |
| D.CuH在氯气中燃烧:CuH + Cl2=" CuCl" + HCl |
工业上粗硅的生产原理为2C+SiO2 Si+2CO↑,下列说法正确的是
Si+2CO↑,下列说法正确的是
| A.SiO2是氧化剂 | B.SiO2发生氧化反应 |
| C.C表现出氧化性 | D.C被还原 |
将0.195g锌粉加入到20.0 mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是
| A.M | B.M2+ | C.M3+ | D.MO2+ |
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1∶1∶1时,实际参加反应的FeS与HNO3的物质的量之比为( )。
| A.1∶6 | B.16∶25 | C.2∶11 | D.1∶7 |
已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应:2S2Cl2+2H2O=4HCl+SO2↑+3S↓。对该反应的说法正确的是 ( )。
| A.S2Cl2既作氧化剂又作还原剂 |
| B.氧化产物与还原产物物质的量之比为3∶1 |
| C.每生成1 mol SO2转移4 mol电子 |
| D.H2O作还原剂 |
将a g铝粉加入过量NaOH溶液中充分反应后,铝粉完全溶解,并收集到标准状况下b L氢气,所得溶液中共有c个AlO2-,反应中转移电子d个。则阿伏加德罗常数(NA)可表示为( )
A.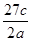 | B.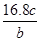 | C.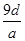 | D.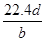 |
根据以下实验事实,判断选项中四种微粒在酸性条件下,氧化性由强到弱的顺序是( )
(1)向FeCl3溶液中滴加KI溶液,再加入CCl4振荡,CCl4层呈紫红色;
(2)向FeCl2溶液中加入氯水,再加入KSCN溶液,溶液呈红色;
(3)向KMnO4溶液中加入浓盐酸,振荡后紫色褪去。
| A.I2>Cl2>Fe3+>MnO4- |
| B.MnO4->Cl2>Fe3+>I2 |
| C.Cl2>I2>Fe3+,MnO4->Fe3+ |
| D.Fe3+>MnO4->Cl2>I2 |