题目内容
下列进行性质比较的实验,不合理的是
| A.比较Cu、Fe的还原性:铜加入硫酸铁溶液中 |
| B.比较氯的非金属性强于溴:溴化钠溶液中通入氯气 |
| C.比较高锰酸钾的氧化性强于氯气:高锰酸钾中加入浓盐酸 |
| D.比较镁的金属性强于铝:取一小段去氧化膜的镁带和铝片,分别加入1.0 mol·L-1的盐酸中 |
A
解析试题分析:A项中,比较Cu、Fe的还原性:铜加入硫酸铁溶液中,尽管铜溶解了,但不能置换出铁单质,不能比较;若铁加入硫酸铜溶液中,铁溶解了,同时置换出铜单质,是可以比较的。
考点:物质的性质的强弱比较实验。

 阅读快车系列答案
阅读快车系列答案在热的稀硫酸溶液中溶解11.4g FeSO4。当加入50mL 0.50mol/L KNO3溶液后,使其中的Fe2+全部转化为Fe3+。KNO3溶液也完全反应,并有NxOy气体逸出,此NxOy气体为
| A.N2O | B.N2O3 | C.NO2 | D.NO |
下列实验方案不能达到预期目的的是( )
| A.用钠、镁分别与水反应,可证明钠、镁的金属性强弱 |
| B.用氯化镁、氯化铝分别于浓氨水反应,可证明钠、镁的金属性强弱 |
| C.用铁、石墨与硫酸铜溶液组成的原电池,可证明铁、铜的金属性强弱 |
| D.把氯气通入溴化钠的水溶液中,看到溶液呈橙色,可证明氯、溴的非金属性强弱 |
甲乙两种非金属,能说明甲比乙的非金属性强的是( )
①甲比乙容易与H2化合;②甲的气态氢化物比乙的气态氢化物稳定;③甲的氧化物对应的水化物的酸性比乙的氧化物对应的水化物酸性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。
| A.①②③ | B.只有⑤ | C.①②③④⑤ | D.①② |
科学家最近研究出一种环保,安全的储氢方法,其原理可表示为:
NaHCO3+H2 HCOONa+H2O,下列有关说法不正确的是( )
HCOONa+H2O,下列有关说法不正确的是( )
| A.储氢、释氢过程均有能量变化 |
| B.NaHCO3、HCOONa均含有离子键和共价键 |
| C.储氢过程中,NaHCO3被还原 |
| D.释氢过程中,每消耗0.1mol H2O放出2.24L的H2 |
在下列反应中,HCl作还原剂的是( )
| A.2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O |
| B.Zn+2HCl=ZnCl2+H2↑ |
| C.NaOH+HCl=NaCl+H2O |
| D.CuO+2HCl=CuCl2+H2O |
新型纳米材料氧缺位铁酸盐(MFe2Ox)(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质。转化流程如图所示,下列有关该转化过程的叙述正确的是( )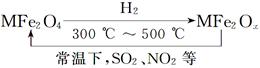
| A.MFe2O4表现了还原性 |
| B.MFe2Ox表现了还原性 |
| C.SO2和NO2表现了还原性 |
| D.SO2和NO2发生了分解反应 |
将0.195g锌粉加入到20.0 mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是
| A.M | B.M2+ | C.M3+ | D.MO2+ |
铜的冶炼大致可分为:
(1)富集,将硫化物矿进行浮选
(2)焙烧,主要反应:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣)
(3)制粗铜,在1200 ℃发生的主要反应:2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑
(4)电解精炼
下列说法正确的是
| A.上述焙烧过程的尾气均可直接排空 |
| B.由6 mol CuFeS2生成6 mol Cu,上述共消耗15 mol O2 |
| C.在反应2Cu2O+Cu2S=6Cu+SO2↑中,作氧化剂的只有Cu2O |
| D.电解精炼时,粗铜应与外电源负极相连 |