��Ŀ����
��ԭ�������Ǵ�������(��Cr2O72����CrO42��)��ҵ��ˮ�ij��÷������������£�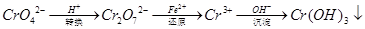
��֪ת�������з�ӦΪ��2CrO42��(aq)+2H+(aq)  Cr2O72��(aq)+H2O��1����ת����������Һ�и�Ԫ�غ���Ϊ28.6g/L��CrO42����10/11ת��ΪCr2O72��������˵������ȷ����
Cr2O72��(aq)+H2O��1����ת����������Һ�и�Ԫ�غ���Ϊ28.6g/L��CrO42����10/11ת��ΪCr2O72��������˵������ȷ����
| A����Һ��ɫ���ֲ��䣬˵���������淴Ӧ�ﵽ��ƽ��״̬ |
| B�������̷�(FeSO4��7H2O)(M=278)����ԭ��������1L��ˮ��������Ҫ917.4g |
| C��������ת����Ӧ��ƽ�ⳣ��K=1��1014����ת����������Һ��pH=6 |
| D��������Ksp[Cr(OH)3]=1��10��32��Ҫʹ�������ˮ��c(Cr3+)����1��10��5mol/L��Ӧ����Һ��pH=5 |
B
�������������A��CrO42��Ϊ��ɫ�ģ�Cr2O72��Ϊ��ɫ�ģ����2CrO42��(aq)+2H+(aq)  Cr2O72��(aq)+H2O��1��δ�ﵽƽ�⣬������У����ɫ����������������ɫ���������Һ��ɫ���ֲ��䣬˵���������淴Ӧ�ﵽ��ƽ��״̬����ȷ��B. ��1L��ˮ��+6�۵�Cr�����ʵ���Ϊn(Cr)=" 28.6g��" 52g/mol ="0.55mol" .����������ԭ��Ӧ�е��ӵ�ʧ��Ŀ��ȿɵá�n(FeSO4��7H2O)=3��0.55mol=1.65mol��m(FeSO4��7H2O) = 1.65mol��278g/mol=458.7g.�����غ�ɵ�0.55mol C. 2CrO42��(aq)+2H+(aq)
Cr2O72��(aq)+H2O��1��δ�ﵽƽ�⣬������У����ɫ����������������ɫ���������Һ��ɫ���ֲ��䣬˵���������淴Ӧ�ﵽ��ƽ��״̬����ȷ��B. ��1L��ˮ��+6�۵�Cr�����ʵ���Ϊn(Cr)=" 28.6g��" 52g/mol ="0.55mol" .����������ԭ��Ӧ�е��ӵ�ʧ��Ŀ��ȿɵá�n(FeSO4��7H2O)=3��0.55mol=1.65mol��m(FeSO4��7H2O) = 1.65mol��278g/mol=458.7g.�����غ�ɵ�0.55mol C. 2CrO42��(aq)+2H+(aq)  Cr2O72��(aq)+H2O��1����ƽ�ⳣ��Ϊ
Cr2O72��(aq)+H2O��1����ƽ�ⳣ��Ϊ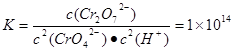 c(CrO42-)="{(28.6��52)��11}mol/L=0.05mol/L," c(Cr2O72-)=(11��2)��c(CrO42-)=0.25mol/L,�����ƽ�ⳣ������ʽ�пɵ�c(H+)=10-6mol/L.����pH=6.��ȷ��D. c(Cr3+)��c3(OH-)=1��10��32. c3(OH-)=1��10��32��1��10��5=1��10��27.����c(OH-)=1��10��9.c(H+)=1��10��14��1��10��9=1��10��5. pH=5.��ȷ.
c(CrO42-)="{(28.6��52)��11}mol/L=0.05mol/L," c(Cr2O72-)=(11��2)��c(CrO42-)=0.25mol/L,�����ƽ�ⳣ������ʽ�пɵ�c(H+)=10-6mol/L.����pH=6.��ȷ��D. c(Cr3+)��c3(OH-)=1��10��32. c3(OH-)=1��10��32��1��10��5=1��10��27.����c(OH-)=1��10��9.c(H+)=1��10��14��1��10��9=1��10��5. pH=5.��ȷ.
���㣺���黹ԭ�������Ǵ���������ҵ��ˮ�Ļ�ѧ��Ӧԭ����֪ʶ��

��ѧ������о���һ�ֻ�������ȫ�Ĵ��ⷽ������ԭ���ɱ�ʾΪ��
NaHCO3+H2 HCOONa+H2O�������й�˵������ȷ����( )
HCOONa+H2O�������й�˵������ȷ����( )
| A�����⡢������̾��������仯 |
| B��NaHCO3��HCOONa���������Ӽ����ۼ� |
| C����������У�NaHCO3����ԭ |
| D����������У�ÿ����0.1mol H2O�ų�2.24L��H2 |
�����з�Ӧ�У�HCl����ԭ�����ǣ� ��
| A��2KMnO4��16HCl(Ũ)��2KCl��2MnCl2��5Cl2����8H2O |
| B��Zn��2HCl��ZnCl2��H2�� |
| C��NaOH��HCl��NaCl��H2O |
| D��CuO��2HCl��CuCl2��H2O |
��֪FeS2��ijŨ�ȵ�HNO3��Ӧʱ����Fe(NO3) 3��H2SO4��ij��һ�Ļ�ԭ�����FeS2�Ͳ��뷴Ӧ��HNO3�����ʵ���֮��Ϊ1��8����÷�Ӧ�Ļ�ԭ������
| A��NO2 | B��NO | C��N2O | D��NH4NO3 |
�⻯��ͭ��CuH����һ�ֲ��ȶ����ʣ�����������ȼ�գ�Ҳ�����ᷴӦ����CuSO4��Һ�͡�ij���ʡ���40��50��ʱ��Ӧ�ɲ������������й������д������
| A���⡰ij���ʡ����л�ԭ�� |
| B��CuH�����ᷴӦ�����ܲ���H2 |
| C��CuH��������ϡ���ᷴӦ��CuH + 3H+ + NO3��= Cu2++ NO��+ 2H2O |
| D��CuH��������ȼ�գ�CuH + Cl2=" CuCl" + HCl |
����������ײʱ����ȫ�����з�����Ӧ10NaN3��2KNO3����K2O��5Na2O��16N2��������������Ȼ�ԭ�����1.75 mol���������ж���ȷ����
| A������40.0 L N2(��״��) |
| B����0.250 mol KNO3������ |
| C��ת�Ƶ��ӵ����ʵ���Ϊ1.25 mol |
| D������ԭ��Nԭ�ӵ����ʵ���Ϊ3.75 mol |
��(Tl)�����軯��(KCN)����ΪA��Σ��Ʒ����֪���з�Ӧ��һ���������ܹ�������(1)Tl3����2Ag=Tl����2Ag����(2)Ag����Fe2��=Ag��Fe3����(3)Fe��2Fe3��=3Fe2�����������������ԱȽ�˳����ȷ���� (����)��
| A��Tl3����Fe3����Ag�� | B��Fe3����Ag����Tl3�� |
| C��Tl����Ag����Fe2�� | D��Tl3����Ag����Fe3�� |
��ҵ���Ը�����(��Ҫ�ɷ�ΪFeO��Cr2O3)��̼���ơ�����������Ϊԭ�������ظ�����
(Na2Cr2O7��2H2O)������Ҫ��Ӧ��(����)
��4FeO��Cr2O3��8Na2CO3��7O2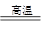 8Na2CrO4��2Fe2O3��8CO2����2Na2CrO4��H2SO4
8Na2CrO4��2Fe2O3��8CO2����2Na2CrO4��H2SO4 Na2SO4��Na2Cr2O7��H2O
Na2SO4��Na2Cr2O7��H2O
����˵������ȷ����(����)
| A����Ӧ�ٺ͢ھ�Ϊ������ԭ��Ӧ |
| B��Na2Cr2O7�ڼ��������¿�ת��ΪNa2CrO4 |
| C�������£�O2�������Դ���Fe2O3��Na2CrO4�� |
| D������1 mol Na2Cr2O7ʱת�Ƶ��ӵ����ʵ�������7 mol |
200��Cʱ��11.6��CO2��ˮ�����Ļ��������������Na2O2��ַ�Ӧ���������������3. 6�ˡ���������Ϣ�У����ǵó������н����в���ȷ����( )
| A�����Լ�������������CO2��ˮ���������� |
| B�������жϳ���������ƽ��Ħ������ |
| C�����Լ�����÷�Ӧ��ת�Ƶĵ����� |
| D�������ܽ��Na2O2�κη�Ӧ�м���������Ҳ����ԭ�� |