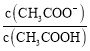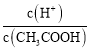题目内容
【题目】微粒M和N,肯定属于同族元素且化学性质相似的是( )
A.结构示意图:M为![]() ,N为
,N为![]()
B.原子核外电子排布式:M为1s22s2,N为1s2
C.M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D.M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
【答案】C
【解析】
A. 结构示意图:M为![]() ,N为
,N为![]() ,它们不属于同族,故A错误;
,它们不属于同族,故A错误;
B. 原子核外电子排布式:M为1s22s2是第IIA族元素,N为1s2是0族元素,它们不属于同族,故B错误;
C. M原子基态2p轨道上有一对成对电子,说明为2p4,N原子基态3p轨道上有一对成对电子,说明为3p4,同主族,化学性质也相似,故C正确;
D. M原子基态2p轨道上有1个未成对电子,可能为2p1或2p5,N原子基态3p轨道上有1个未成对电子,可能为3p1或3p5,因此可能不是同主族,故D错误。
综上所述,答案为C。

【题目】常温下,部分酸的电离平衡常数如下:
化学式 | HF | HCN | H2CO3 |
电离常数 | Ka=3.5×10﹣4 | Ka=5.0×10﹣10 | Ka1=4.3×10﹣7, Ka2=5.6×10﹣11 |
(1)c(H+)相同的三种酸,其酸的浓度从大到小为________________。
(2)0.0lmol/L的HCN溶液中,c(H+)约为_____mol/L。使此溶液中HCN的电离程度增大且c(H+)也增大的方法是_______________________。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a_____b(填“大于”、“小于”或“等于”,下同)b。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1_____n2。
(4)向NaCN中通入少量的CO2,发生的离子方程式为_______________。
(5)设计实验证明氢氟酸比盐酸的酸性弱__________________。