题目内容
【题目】按要求回答下列问题:
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是______________。
(2)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S。只由离子键构成的物质是_________;只由极性共价键构成的物质是_____;由极性键和非极性键构成的物质是_______;由离子键和极性键构成的物质是_______。(填序号)。
(3)写出下列物质的电子式:CaF2:______________CO2:______________ NH4Cl:________________。
(4) 用电子式表示下列化合物的形成过程:H2S:__________________________________;MgCl2:_____________________________。
【答案】![]() ⑤ ⑦ ④ ③⑥
⑤ ⑦ ④ ③⑥ ![]()
![]()

![]()
![]()
【解析】
(1)根据质子数与电子数的关系确定是否带电荷及电荷的多少、电性,根据质子数、中子数确定质量数;
(2)一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,据此分析解答;
(3)CaF2中存在Ca2+和F-离子,通过离子键结合在一起;二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子;氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;
(4)根据硫化氢中硫原子与氢原子之间通过共价键形成的共价化合物;氯化镁是氯离子和镁离子之间通过离子键形成的离子化合物。
(1)核中有17个质子,为Cl元素,有20个中子,质量数为17+20=37,核外有18个电子,核内质子数比核外电子数少1,所以该微粒是带一个单位负电荷,为阴离子,该粒子的化学符号是![]() ;
;
(2)①H2中只含非极性键;
②Na2O2中钠离子与过氧根离子之间存在离子键,存在O-O非极性键,属于离子化合物;
③NaOH中含有离子键和O-H极性键,属于离子化合物;
④H2O2中存在H-O极性键和O-O非极性键,属于共价化合物;
⑤CaCl2只存在离子键,属于离子化合物;
⑥NH4NO3中存在离子键和极性键,属于离子化合物;
⑦H2S中只存在极性共价键,为共价化合物;
则:只由离子键构成的物质是⑤;只由极性共价键构成的物质是⑦;由极性键和非极性键构成的物质是④;由离子键和极性键构成的物质是③⑥;
(3)CaF2中存在Ca2+和F-离子,电子式为![]() ;二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:
;二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:![]() ;氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为:
;氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: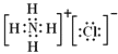 ;
;
(4)H2S的形成过程为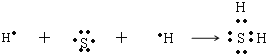 ,MgCl2的形成过程为
,MgCl2的形成过程为![]() 。
。