题目内容
【题目】金属钒(V)及其化合物有着广泛的用途。请回答下列问题:
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图1所示。V2O74-中V元素的化合价是________,溶液中VO3-转化为V2O74-的离子方程式为________。

(2)偏钒酸铵是最普通的钒酸盐,将V2O5溶于碳酸钠溶液中(有气体生成),然后加入氯化铵,便可析出偏钒酸铵(NH4VO3),该过程总反应的化学方程式为________;当pH超过8.0时偏钒酸铵会发生转化,其原因是溶液中的VO3-转化为V2O74-、________(请另写出一点原因)。
(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g)![]() 2SO3(g)ΔH=pkJ/mol反应的催化剂,其催化原理如图2所示。
2SO3(g)ΔH=pkJ/mol反应的催化剂,其催化原理如图2所示。

①过程a和过程b的热化学方程式为
V2O5(s)+SO2(g)=V2O4(s)+SO3(g) ΔH=qkJ/mol
V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) ΔH=rkJ/mol
则过程c的热化学方程式为_________。
②T℃时反应2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0中SO3的转化率(α)与体系总压强(p)的关系如图3所示。T℃时,将2molSO3置于10L密闭容器中,反应达到平衡后,体系总压强为0.10MPa。则T℃时B点的化学平衡常数Kc=_________。
2SO2(g)+O2(g) ΔH>0中SO3的转化率(α)与体系总压强(p)的关系如图3所示。T℃时,将2molSO3置于10L密闭容器中,反应达到平衡后,体系总压强为0.10MPa。则T℃时B点的化学平衡常数Kc=_________。

(4)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图4所示。
①充电过程中,右槽溶液颜色逐渐由________色变为________色;
②充电时若转移的电子数为NA个,则左槽溶液中n(H+)的变化量为______。

【答案】+5 2VO3-+2OH-=V2O74-+H2O V2O5+Na2CO3+2NH4Cl=2NH4VO3+2NaCl+CO2↑ pH过大,溶液中的NH4+会转化为NH3·H2O 2VOSO4(s)=V2O5(s)+SO3(g)+SO2(g) △H=(p-q-r)kJ/mol 0.00125 绿 紫 1mol
【解析】
(1)根据化合物中元素化合价代数和等于0分析判断,根据图示,在碱性溶液中VO3-转化为V2O74-;
(2)V2O5、Na2CO3、NH4Cl混合发生反应产生NH4VO3、CO2气体及NaCl,据此书写反应方程式;根据NH4+与OH-不能大量共存分析;
(3)①根据盖斯定律,将已知的热化学方程式叠加,可得待求反应的热化学方程式;
②SO3的平衡转化率为20%,则反应的三氧化硫为0.4mol,根据三段式计算平衡时各组分物质的量浓度,根据平衡压强,结合气体的物质的量、计算平衡浓度,带入平衡常数表达式K=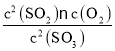 计算平衡常数;
计算平衡常数;
(4)充电时阳极发生氧化反应,阴极发生还原反应,根据不同价态离子的颜色判断;
(1)O元素化合价为-2价,则在V2O74-中V元素的化合价是(2×7-4)÷2=+5价;根据图示,在碱性溶液中VO3-转化为V2O74-,转化的离子方程式是2VO3-+2OH-=V2O74-+H2O;
(2)V2O5、Na2CO3、NH4Cl混合发生反应产生NH4VO3、CO2及NaCl,反应方程式为:V2O5+Na2CO3+2NH4Cl=2NH4VO3+2NaCl+CO2↑;根据图示可知:当溶液pH在8~10时, VO3-转化为V2O74-,同时溶液中的NH4+与OH-会发生反应,转化为弱电解质NH3·H2O;
(3)①(i)2SO2(g)+O2(g)![]() 2SO3(g)△H=pkJ/mol
2SO3(g)△H=pkJ/mol
(ii)V2O5(s)+SO2(g)=V2O4(s)+SO3(g) ΔH=qkJ/mol
(iii)V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) ΔH=rkJ/mol
根据盖斯定律,①-②-③得过程iii的反应为:2VOSO4(s)=V2O5(s)+SO3(g)+SO2(g),△H=(p-q-r)kJ/mol;
②T℃时,将2molSO3置于10L密闭容器中,反应开始时,c(SO3)=2mol÷10L=0.2mol/L,反应达到平衡后,体系总压强为0.10MPa,此时SO3的平衡转化率为20%,则反应的三氧化硫的物质的量n(SO3)=2mol×20%=0.4mol,容器体积为10L,则△c(SO3)=0.4mol÷10L=0.04mol/L,平衡时c(SO3)=0.2mol/L-0.04mol/L=0.16mol/L,c(SO2)=0.04mol/L,c(O2)=0.02mol/L,则该反应的化学平衡常数K=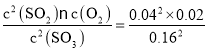 mol/L=0.00125mol/L
mol/L=0.00125mol/L
(4)①在充电时,右侧阴极上发生还原反应,V3+获得电子变为V2+,右侧会看到溶液由绿色变为紫色;
②充电时右侧发生还原反应:V3++e-=V2+,每转移1mol电子,右侧正电荷数目减少NA个,所以转移的电子数为NA个,溶液中H+会通过质子交换膜由左侧进入右侧,则左槽n(H+)的变化量为1mol。