题目内容
5. 已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g)=SO2C12(g)△H<0,SO2Cl2是一种无色液体,熔点-54.1℃,沸点69.1℃,极易水解,遇潮湿空气会产生白雾.
已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g)=SO2C12(g)△H<0,SO2Cl2是一种无色液体,熔点-54.1℃,沸点69.1℃,极易水解,遇潮湿空气会产生白雾.(1)化合物SO2Cl2中S元素的化合价是+6.
(2)用二氧化锰和浓盐酸制氯气的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)用如图所示的装置制备SO2Cl2,下列说法正确是bc(选填编号)
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性碳作催化剂
c.装置C处吸滤瓶应放在冰水中冷却,更有利于SO2Cl的收集
(4)B处反应管冷却水应从n(填“m”或“n”) 接口通入,从化学平衡移动角度分析,反应管通水冷却的目的是正反应为放热反应,降低温度,平衡向正反应方向移动,有利于SO2Cl2生成,D处U形管中盛放的试剂可以是CaCl2.
(5)向C中所得液体中加水,出现白雾,振荡、静置得到无色溶液.经检验该溶液中的阴离子只有SO42-、Cl-(OH-除外),写出SO2Cl2与H2O反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl.
(6)已知室温下,Ksp[AgCl]=2.0×10-10,Ksp[Ag2SO4]=1.6×10-5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,使SO42-和Cl-完全沉淀.当浊液中Ag+浓度为0.1mol/L时,此浊液中Cl-与SO42-的物质的量浓度之比为1.25×10-6:1.
分析 (1)化合物SO2Cl2中O元素为-2价、Cl元素为-1价,根据化合价规则计算S元素的化合价;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水;
(3)a.由于SO2Cl2极易水解,遇潮湿空气会产生白雾,A、E处洗气瓶作用为吸水干燥气体;
b.B处活性碳应作催化剂;
c.反应为反应热反应,得到气态SO2C12,装置C处吸滤瓶应放在冰水中冷却,使SO2Cl2液化;
(4)B中反应得到气态SO2C12,应充满冷凝水充分冷却,采取逆流原理;正反应为放热反应,降低温度,有利于SO2Cl2生成;D处U形管中盛放的试剂吸收空气中的水蒸气,防止加入C中导致SO2C12水解;
(5)向SO2C12中加水,出现白雾,振荡、静置得到无色溶液.经检验该溶液中的阴离子只有SO42-、Cl-(OH-除外),说明SO2C12水解生成H2SO4、HCl;
(6)根据溶度积可知,溶液中c(Cl-)=$\frac{Ksp(AgCl)}{c(A{g}^{+})}$,c(SO42-)=$\frac{Ksp(A{g}_{2}S{O}_{4})}{{c}^{2}(A{g}^{+})}$,据此计算.
解答 解:(1)化合物SO2Cl2中O元素为-2价、Cl元素为-1价,令S元素化合价为x,根据化合价规则x+2×(-2)-1=0,故x=6,即S元素的化合价为+6,
故答案为:+6;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)a.由于SO2Cl2极易水解,遇潮湿空气会产生白雾,A、E处洗气瓶作用为吸水干燥气体,二氧化硫和氯气都可以用浓硫酸干燥,而饱和食盐水和饱和NaHSO3溶液起不到干燥的作用,故a错误;
b.B处活性碳应作催化剂,故b正确;
c.反应为反应热反应,得到气态SO2C12,装置C处吸滤瓶应放在冰水中冷却,使SO2Cl2液化,有利于SO2Cl的收集,同时利平衡正向移动,提高产率,故正确,
故选:bc;
(4)B中反应得到气态SO2C12,应充满冷凝水充分冷却,采取逆流原理,即从n口接入冷凝水;
正反应为放热反应,降低温度,平衡向正反应方向移动,有利于SO2Cl2生成;
D处U形管中盛放的试剂吸收空气中的水蒸气,防止加入C中导致SO2C12水解,可以用CaCl2等干燥,
故答案为:n;正反应为放热反应,降低温度,平衡向正反应方向移动,有利于SO2Cl2生成;CaCl2;
(5)向SO2C12中加水,出现白雾,振荡、静置得到无色溶液.经检验该溶液中的阴离子只有SO42-、Cl-(OH-除外),说明SO2C12水解生成H2SO4、HCl,反应方程式为:SO2Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2Cl2+2H2O=H2SO4+2HCl;
(6)根据溶度积可知,溶液中c(Cl-)=$\frac{Ksp(AgCl)}{c(A{g}^{+})}$,c(SO42-)=$\frac{Ksp(A{g}_{2}S{O}_{4})}{{c}^{2}(A{g}^{+})}$,则Cl-与SO42-的物质的量浓度之比为 $\frac{Ksp(AgCl)}{c(A{g}^{+})}$:$\frac{Ksp(A{g}_{2}S{O}_{4})}{{c}^{2}(A{g}^{+})}$=c(Ag+)×Ksp(AgCl):Ksp(Ag2SO4)=0.1×2.0×10-10:1.6×10-5=1.25×10-6:1,
故答案为:1.25×10-6:1.
点评 本题考查化学制备实验、对装置与操作的分析评价、对信息获取及应用、溶度积有关计算等,关键是明确原理,需要学生具备扎实的基础与灵活运用的能力,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 水和酒精 | B. | 溴乙烷和水 | C. | 溴苯和水 | D. | 苯和水 |
| A. | 等于18s | B. | 等于12s | C. | 大于18s | D. | 小于18s |
| A. | 0.01mol•L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-) | |
| B. | 0.1 mol•L-1NaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-) | |
| C. | 等物质的量的NH4Cl和NaCl的混合溶液:c(NH4+)+c(NH3•H2O)+c(Na+)=2c(Cl-) | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的Na2CO3溶液:c(HCO3-)+c(H2CO3)=c(10-2-10-12) mol•L-1 |
 在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:
在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H
已知:①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)△H=2△H1+△H2-2△H3.(用△H1、△H2和△H3表示)
(2)某温度下,在体积固定为2L的密闭容器中进行反应①,将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
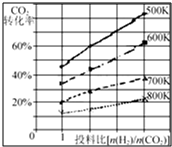
(3)已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如右图所示.从图中可得出三条主要规律:
①增大投料比,CO2的转化率增大;
②升高温度,CO2的转化率降低;
③温度越低,增大投料比使CO2的转化率增大的越显著.
(4)为提高CO2的转化率,除了适当改变温度、压强和投料比外,还可以采取的措施是:将水蒸汽液化移去(或移去产物).
(5)由甲醇液相脱水法也可制二甲醚,首先将甲醇与浓硫酸反应生成硫酸氢甲酯(CH3OSO3H):CH3OH+H2SO4→CH3OSO3H+H2O;生成的硫酸氢甲酯再和甲醇反应生成二甲醚,第二步的反应方程式为:CH3OSO3H+CH3OH→CH3OCH3+H2SO4.与CO2和H2反应制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是浓H2SO4腐蚀设备或有硫酸废液产生.
| A. | 标准状况下,用一充满氨气的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内氨水的物质的量的浓度为$\frac{1}{22.4}$ mol/L | |
| B. | 氨很容易液化,因此氨常用作制冷剂 | |
| C. | SO3溶于水能导电,所以SO3是电解质 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
| A. | Ca(NO3)2 | B. | NaCl | C. | H2O | D. | KOH |
| A. | 相对分子质量相近的醇比烷烃沸点高是因为醇分子间存在氢键 | |
| B. | 苯和乙醇均不能使酸性高锰酸钾溶液褪色 | |
| C. | 红外光谱分析不能区分乙醇和乙酸乙酯 | |
| D. | 蛋白质、纤维素、蔗糖、淀粉都是高分子化合物 |
| A. | ⅠA族元素 | B. | +7价元素 | C. | 三周期元素 | D. | 金属元素 |