题目内容
14.铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.(1)还原沉淀法是处理含Cr2O72- 和CrO42-工业废水的一种常用方法,其工艺流程为:
2CrO42-$→_{Ⅰ转化}^{H+}$Cr2O72 $→_{Ⅱ还原}^{Fe_{2}+}$ Cr3+$→_{Ⅲ}^{OH-}$Cr(OH)3↓
其中第I步存在平衡:2CrO42-(黄色)+2H+═Cr2O72- (橙色)+H2O
①若平衡体系的pH=2,该溶液显橙色.
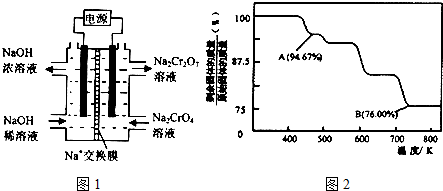
②根据2CrO42-+2H+?Cr2O72-+H2O,设计右图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7.Na2Cr2O7中铬元素的化合价为+6,图中右侧电极连接电源的正极,其电极反应式为4OH--4e-=O2↑+2H2O.
③第Ⅱ步反应的离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,向Ⅱ反应后的溶液加一定量NaOH,若溶液中c(Fe3+)=2.0×10-12mol•L-1,则溶液中c(Cr3+)=3×10-5mol•L-1.(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31).
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火.若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3.完成该反应的化学方程式:
4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O
(3)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图2所示.B点时剩余固体的成分是Cr2O3(填化学式).
分析 (1)①根据氢离子对2CrO42-(黄色)+2H+═Cr2O72- (橙色)+H2O平衡移动的影响判断;
②根据2CrO42-+2H+?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明在该电极是阳极,连接电源的正极,电极反应式为4OH--4e-=O2↑+2H2O;
③亚铁离子与Cr2O72-发生氧化还原反应,由c(Fe3+)和Ksp[Fe(OH)3]计算c(OH-),结合Ksp[Cr(OH)3]计算c(Cr3+);
(2)根据化合价升降总数相等以及原子守恒来解答;
(3)根据质量守恒定律,在变化过程中,Cr的质量没有变,求出氧原子和铬原子的个数比即可.
解答 解:(1)①若平衡体系的pH=2,溶液酸性较强,平衡2CrO42-(黄色)+2H+═Cr2O72- (橙色)+H2O正向移动,溶液呈橙色,故答案为:橙;
②由化合价代数和为0可知Na2Cr2O7中铬元素的化合价为+6价,根据2CrO42-+2H+?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明在该电极是阳极,连接电源的正极,电极反应式为4OH--4e-=O2↑+2H2O,
故答案为:+6;正极;4OH--4e-=O2↑+2H2O;
③亚铁离子与Cr2O72-发生氧化还原反应,反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
向Ⅱ反应后的溶液加一定量NaOH,若溶液中c(Fe3+)=2.0×10-12mol•L-1,则c(OH-)=$\root{3}{\frac{4.0×1{0}^{-38}}{2.0×1{0}^{-12}}}$mol/L,
c(Cr3+)=3×10-5,
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;3×10-5;
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],铬的化合价从+6价降低到+3价,1个CrO3化合价变化3,两者的最小公倍数是12,再根据原子守恒得4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O,
故答案为:4;3;6;2;3;9H2O;
(3)设固体质量为100g,B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为16,两者的个数比为$\frac{52}{52}$:$\frac{24}{16}$=2:3,所以B点时剩余固体的成分是Cr2O3,所以加热到 750K 时成分是Cr2O3,故答案为:Cr2O3.
点评 本题综合考查了化学平衡原理、氧化还原反应、离子方程式的书写、沉淀溶解平衡和Ksp的有关计算等内容,侧重于反应原理的应用的考查,分析时要根据题给信息,结合相关原理进行解答,题目难度中等.

| A. | Ba2+、Ca2+、Br-、Cl- | B. | CO32-、SO32-、K+、NH4+ | ||
| C. | Na+、NH4+、I-、HS- | D. | Na+、Ca2+、ClO-、NO3- |
| A. | 0.1mol•L-1的CH3COOH溶液中:c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1mol•L的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.1mol•L的NH4Cl溶液中:c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol•L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
 某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
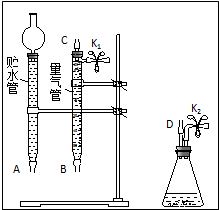
某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.(1)现有以下仪器和用品:橡胶管、秒表、温度计、amol/L稀硝酸、bmol/L稀硝酸及下图中仪器.
①写出本实验的化学方程式,并标出电子转方向和数目:
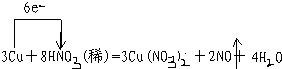 .
.②设计实验方案:在相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度)下,测定相同时间内产生气体体积(或产生相同体积的气体所需的时间).
③在答卷的图中将A、B、C、D、几处用橡胶管
以正确方式连接起来,以测定反应所产生气体的
体积(三个容器中的液体和水都已画出).
④测定前,为避免NO被氧化为NO2,要用CO2
排出锥形瓶和橡胶管中的空气:装入铜片、松开K2弹簧夹,从K2处的橡胶管向装置中通入CO2,此时K1处应进行的操作是松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止.
(2)在K2处注入硝酸发生反应.在给定条件下设计实验探究浓度和温度对化学反应速率的影响:温度25℃、50℃;时间t1、t2、t3;收集气体体积V1、V2.请完成下表:
| 实验 编号 | 稀硝酸的浓度/(mol/L) | 稀硝酸的体积/mL | 温度 /℃ | 时间 /min | 收集气体 的体积/mL |
| ① | a | V | 25 | t1 | V1 |
| ② | V | ||||
| ③ | V |
| A. | 加入足量BaCl2溶液反应,过滤、洗涤、干燥、恒重,称得固体质量为W1 g | |
| B. | 加入过量的W2 g Zn充分反应后,过滤、洗涤、干燥、恒重,称得固体质量为W3 g | |
| C. | 加入过量的W4 g CaCO3反应停止后,过滤、洗涤、干燥、恒重,称得固体质量为W5 g | |
| D. | 滴入适当指示剂,用已知浓度的NaOH溶液进行滴定,消耗NaOH溶液的体积为V mL |
| A. | 分馏 | B. | 裂化 | C. | 裂解 | D. | 干馏 |
| A. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和(a+1),则有c1=10c2. | |
| B. | 10mL0.1mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中有c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 在0.1mol•L-1NaHSO3溶液中有c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) | |
| D. | pH<7的某二元弱酸是酸式盐NaHA溶液中有c(H+)+2c(A2-)=c(OH-)+c(H2A) |
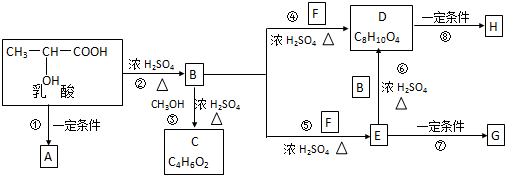
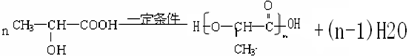 .
.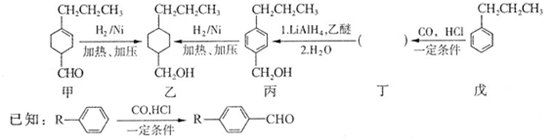
 和
和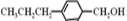 生成(写结构简式).
生成(写结构简式). .
. +H2O$→_{△}^{NaOH}$
+H2O$→_{△}^{NaOH}$ +HCl或
+HCl或