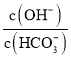题目内容
【题目】A、B、C、D、E为同一周期原子序数依次增大的短周期主族元素,已知A、B、D三种原子最外层共有10个电子,且这三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的核电荷数是最外层电子数的3倍。
(1)A的单质在空气中燃烧的产物为____填化学式)。
(2)D、E的最高价氧化物的水化物的酸性比较:_______ (用化学式表示)。
(3)元素E形成的单质通入D的一种氧化物的水溶液中发生反应,生成两种常见的强酸。该反应的化学方程式为____。
(4)写出B、A两元素的最高价氧化物的水化物相互反应的离子方程式:____。
【答案】Na2O2 HClO4>H2SO4 Cl2+ SO2+2H2O = 2HCl + H2SO4 Al(OH)3+ OH-=AlO![]() + 2H2O
+ 2H2O
【解析】
A、B、C、D、E为同一周期原子序数依次增大的短周期主族元素,C元素的核电荷数是最外层电子数的3倍,C是P元素;氢氧化铝具有两性,既能和强酸反应又能和强碱反应,A、B、D三种原子最外层共有10个电子,且这三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,说明A、B、D中一定含有Al元素, 则A是Na元素、B是Al元素,D是S元素、E是Cl元素。
(1)A是Na元素,钠在空气中燃烧的产物为过氧化钠,化学式是Na2O2;
(2)D是S元素、E是Cl元素,同周期元素从左到右非金属性增强,所以最高价氧化物的水化物的酸性:HClO4>H2SO4;
(3)E是Cl元素,氯气和二氧化硫的水溶液反应生成硫酸和盐酸,该反应的化学方程式为Cl2+ SO2+2H2O=2HCl + H2SO4;
(4)Al、Na两元素的最高价氧化物的水化物分别是Al(OH)3、NaOH,Al(OH)3、NaOH反应生成偏铝酸钠和水,反应的离子方程式是Al(OH)3+ OH-=AlO![]() + 2H2O。
+ 2H2O。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案