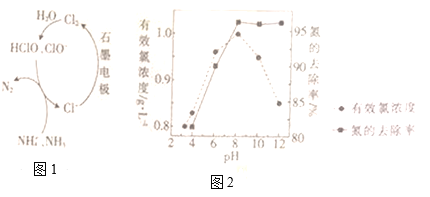
题目内容
【题目】下列对各电解质溶液的分析正确的是( )
A.硫酸铁溶液中能大量共存的离子:K+、Na+、NO3-、CO32-
B.Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.0.1molL﹣1Na2S溶液中存在:c(OH-)=c(H+)+c(HS﹣)+2c(H2S)
D.NH4HSO4溶液呈酸性的主要原因是:NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
【答案】C
【解析】
A.Fe3+与CO32-在溶液中会发生反应产生Fe(OH)3沉淀和CO2气体,不能大量共存,A错误;
B.NaOH过量时,以Ca(HCO3)2溶液为标准,离子方程式为2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-,B错误;
C.根据质子守恒可得关系式c(OH-)=c(H+)+c(HS﹣)+2c(H2S),C正确;
D.NH4HSO4溶液呈酸性的主要原因是:NH4HSO4=NH4++H++SO42-,D错误;
故合理选项是C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
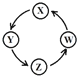
【题目】下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有( )
序号 | X | Y | Z | W |
|
① | Si | Na2SiO3 | H2SiO3 | SiO2 | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.②③B.①③④C.①④D.①②③