题目内容
13.同温同体积同质量的CO2、CO、H2、O2的压强,按从大到小的顺序排列正确的是( )| A. | H2>O2>CO>CO2 | B. | H2>CO>O2>CO2 | C. | CO2>O2>CO>H2 | D. | CO2>H2>O2>CO |
分析 相同条件下,气体物质的量与气体的压强成正比,同温同体积同质量的CO2、CO、H2、O2这几种气体,气体的物质的量越大,其压强越大,相同质量时气体的物质的量与摩尔质量成反比,据此分析解答.
解答 解:相同条件下,气体物质的量与气体的压强成正比,同温同体积同质量的CO2、CO、H2、O2这几种气体,气体的物质的量越大,其压强越大,相同质量时气体的物质的量与摩尔质量成反比,所以这几种气体的压强与摩尔质量成反比,
CO2、CO、H2、O2的摩尔质量分别为:44g/mol、28g/mol、2g/mol、32g/mol,
所以这几种气体的压强从大到小顺序为:H2>CO>O2>CO2,
故选B.
点评 本题考查阿伏伽德罗定律及其推论,题目难度中等,明确物质的量公式中各个物理量的关系是解本题关键,正确判断压强与摩尔质量的关系即可解答,注意熟练掌握阿伏伽德罗定律及其推论的内容.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
4.从2008年6月1日起,我国禁止生产、销售、使用超薄塑料购物袋.下列对聚乙烯塑料叙述不正确的是( )
| A. | 它属于有机高分子 | B. | 它能产生“白色污染” | ||
| C. | 它形成的单体是乙烯 | D. | 聚乙烯中含有双键不稳定,易变质 |
8.英国剑桥大学用电解法直接从TiO2获得Ti,他们把多孔TiO2颗粒熔于熔融的CaCl2,通电后得海绵钛和氧.研究者之一的Chen指出,试生产表明,这种方法比传统的kroll法便宜三分之一.这种电解工艺一旦投入实际生产,钛的价格将大大下降,这种新工艺可能带有普遍性,可用于生产稀土、锕系以及其他金属.下列有关说法错误的是( )
| A. | 电解时阳极获得O2 | |
| B. | 电解时阴极获得海绵钛 | |
| C. | 电解时阳极有Cl2放出 | |
| D. | 电解工艺一旦投入实际生产,钛将可与不锈钢和铝合金竞争 |
2.过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域.湿法工艺制取过氧化尿素是用低浓度的双氧水和饱和尿素溶液在一定条件下合成过氧化尿素.反应的方程式为:CO(NH2)2+H2O2 $\frac{\underline{\;30℃\;}}{\;}$CO(NH2)2•H2O2△H<0.过氧化尿素的部分性质如下:
湿法合成过氧化尿素的流程图如下:

请回答下列问题:
(1)反应器的加热方式是水浴加热;反应温度需控制在适当温度下进行,温度不能过高的原因是温度过高,产品易分解,致使活性氧含量降低,温度也不能过低的原因是温度过低,反应速率太慢,且反应体系制冷需要消耗大量能量.
(2)若欲从母液中分离出H2O2和尿素,可采用的操作是减压蒸馏、结晶.
(3)干法工艺制取过氧化尿素的方法是:采用高浓度双氧水水溶液喷雾到无水尿素固体上进行反应,水和反应热通过流态床移去而得到干燥的过氧化尿素产品.
比较干法与湿法两种工艺,你认为干法工艺的优点是:流程短,工艺简单(答出一点即可),干法工艺的缺点是:双氧水浓度高经济效益低,设备复杂等(答出两点即可),湿法工艺的优点是:低浓度双氧水,经济效益高,设备简单易于达到,母液可循环使用等(答出两点即可).
(4)准确称取0.6000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6mol•L-1H2SO4,用0.1000mol•L-1KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2•H2O2的质量分数为78.3%(结果保留到小数点后一位).
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75-85℃ | 易溶于水、有机溶剂 |

请回答下列问题:
(1)反应器的加热方式是水浴加热;反应温度需控制在适当温度下进行,温度不能过高的原因是温度过高,产品易分解,致使活性氧含量降低,温度也不能过低的原因是温度过低,反应速率太慢,且反应体系制冷需要消耗大量能量.
(2)若欲从母液中分离出H2O2和尿素,可采用的操作是减压蒸馏、结晶.
(3)干法工艺制取过氧化尿素的方法是:采用高浓度双氧水水溶液喷雾到无水尿素固体上进行反应,水和反应热通过流态床移去而得到干燥的过氧化尿素产品.
比较干法与湿法两种工艺,你认为干法工艺的优点是:流程短,工艺简单(答出一点即可),干法工艺的缺点是:双氧水浓度高经济效益低,设备复杂等(答出两点即可),湿法工艺的优点是:低浓度双氧水,经济效益高,设备简单易于达到,母液可循环使用等(答出两点即可).
(4)准确称取0.6000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6mol•L-1H2SO4,用0.1000mol•L-1KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2•H2O2的质量分数为78.3%(结果保留到小数点后一位).
9.草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂,某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:

已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9.
②相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1,.0mol•L-1计算).
(1)“粉碎”的目的是增大接触面积,加快反应速率;提高镍的浸出率.
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).

a.30℃、30min b.90℃、150min c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不再产生沉淀,则“沉镍”工序已经完成.将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7.第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
(6)已知废镍催化剂中镍的质量分数为5.9%,则100kg废镍催化剂最多可制得18.3kg草酸镍晶体(Ni:59,C:12,H:1,O:16).

已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9.
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
(1)“粉碎”的目的是增大接触面积,加快反应速率;提高镍的浸出率.
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).

a.30℃、30min b.90℃、150min c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不再产生沉淀,则“沉镍”工序已经完成.将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7.第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
(6)已知废镍催化剂中镍的质量分数为5.9%,则100kg废镍催化剂最多可制得18.3kg草酸镍晶体(Ni:59,C:12,H:1,O:16).

 .
.
 最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如图:
最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如图: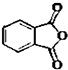 +C4H9OH$\stackrel{H_{2}SO_{4}}{→}$
+C4H9OH$\stackrel{H_{2}SO_{4}}{→}$ 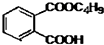 $→_{C_{4}H_{9}OH}^{H_{2}SO_{4}}$
$→_{C_{4}H_{9}OH}^{H_{2}SO_{4}}$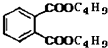
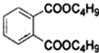 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH. 白磷结构如图所示,与O2反应生成P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有共价键的数目是( )
白磷结构如图所示,与O2反应生成P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有共价键的数目是( )