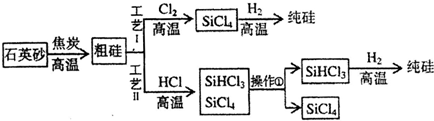
题目内容
2.过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域.湿法工艺制取过氧化尿素是用低浓度的双氧水和饱和尿素溶液在一定条件下合成过氧化尿素.反应的方程式为:CO(NH2)2+H2O2 $\frac{\underline{\;30℃\;}}{\;}$CO(NH2)2•H2O2△H<0.过氧化尿素的部分性质如下:| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75-85℃ | 易溶于水、有机溶剂 |

请回答下列问题:
(1)反应器的加热方式是水浴加热;反应温度需控制在适当温度下进行,温度不能过高的原因是温度过高,产品易分解,致使活性氧含量降低,温度也不能过低的原因是温度过低,反应速率太慢,且反应体系制冷需要消耗大量能量.
(2)若欲从母液中分离出H2O2和尿素,可采用的操作是减压蒸馏、结晶.
(3)干法工艺制取过氧化尿素的方法是:采用高浓度双氧水水溶液喷雾到无水尿素固体上进行反应,水和反应热通过流态床移去而得到干燥的过氧化尿素产品.
比较干法与湿法两种工艺,你认为干法工艺的优点是:流程短,工艺简单(答出一点即可),干法工艺的缺点是:双氧水浓度高经济效益低,设备复杂等(答出两点即可),湿法工艺的优点是:低浓度双氧水,经济效益高,设备简单易于达到,母液可循环使用等(答出两点即可).
(4)准确称取0.6000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6mol•L-1H2SO4,用0.1000mol•L-1KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2•H2O2的质量分数为78.3%(结果保留到小数点后一位).
分析 (1)反应控制温度30℃,应采取水浴加热;温度45℃,CO(NH2)2•H2O2发生分解,温度过低,反应速率太慢,且制冷需要消耗能量;
(2)减压蒸馏分离得到H2O2,然后结晶得到尿素;
(3)对比分析可知,干法制备:流程短,工艺简单,但双氧水浓度高经济效益低,设备复杂等,而湿法制备:低浓度双氧水,经济效益高,设备简单易于达到,母液可循环使用等;
(4)尿素与KMnO4溶液不反应,滴定发生的反应为:5H2O2+2KMnO4+3H2SO4=8H2O+2MnSO4+K2SO4+5O2↑,可得关系式5CO(NH2)2•H2O2~2KMnO4,根据消耗高锰酸钾的物质的量计算CO(NH2)2•H2O2的物质的量,进而计算产品中CO(NH2)2•H2O2的质量分数.
解答 解:(1)CO(NH2)2•H2O2的制备控制温度30℃,CO(NH2)2•H2O2在45℃时发生分解,所以不能用酒精灯直接加热,应该用水浴加热;温度过高,产品易分解,致使活性氧含量降低;温度过低,反应速率太慢,且反应体系制冷需要消耗大量能量,
故答案为:水浴加热;温度过高,产品易分解,致使活性氧含量降低;温度过低,反应速率太慢,且反应体系制冷需要消耗大量能量;
(2)母液可以循环使用提高原料利用率,母液中含有H2O2和尿素,减压蒸馏分离得到H2O2,然后结晶得到尿素,
故答案为:减压蒸馏、结晶;
(3)对比分析可知,干法制备优点:流程短,工艺简单,缺点:双氧水浓度高经济效益低,设备复杂等,湿法制备优点:低浓度双氧水,经济效益高,设备简单易于达到,母液可循环使用等,
故答案为:流程短,工艺简单;双氧水浓度高经济效益低,设备复杂等;低浓度双氧水,经济效益高,设备简单易于达到,母液可循环使用等;
(4)尿素与KMnO4溶液不反应,滴定发生的反应为:5H2O2+2KMnO4+3H2SO4=8H2O+2MnSO4+K2SO4+5O2↑,可得关系式5CO(NH2)2•H2O2~2KMnO4,n[CO(NH2)2•H2O2]=$\frac{5}{2}$n(KMnO4)=$\frac{5}{2}$×0.1000mol•L-1×0.02L=0.005mol,其质量为0.005mol×94g/mol=0.47g,所以产品中CO(NH2)2•H2O2的质量分数为$\frac{0.47g}{0.6g}$×100%=78.3%,
故答案为:78.3%.
点评 本题考查了物质的制备实验,涉及实验基本操作、对工艺流程的分析评价、氧化还原滴定、化学计算等,难度中等,是对知识的综合运用与分析解决问题能力的考查,注意利用关系式进行计算.

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案| A. | 重金属、农药等会造成水体污染 | |
| B. | 装饰材料中的甲醛、苯等会造成居室污染 | |
| C. | SO2会导致酸雨的形成 | |
| D. | 含磷洗涤剂大量使用易造成水华、赤潮 |
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3 和HCl混合溶液 | |
| B. | 正极为C,负极为Fe,电解质溶液为Fe(NO3)3 和HNO3混合溶液 | |
| C. | 正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 和H2SO4混合溶液 | |
| D. | 正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 和HCl混合溶液 |
| A. | H2>O2>CO>CO2 | B. | H2>CO>O2>CO2 | C. | CO2>O2>CO>H2 | D. | CO2>H2>O2>CO |

部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(2)图中所示滤液中含钒的主要成分为VOSO4(写化学式).
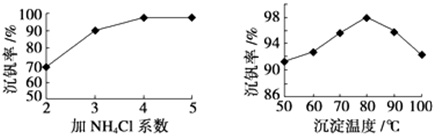
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据下图判断最佳控制氯化铵系数和温度为4、80℃.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式:
□VO2+□H2C2O4+□H+═□VO2++□CO2↑+□H2O.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为V${{O}_{2}}^{+}$+V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.
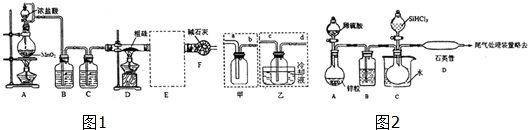
亚硫酸钠法:Na2SO3+S+5H2O=Na2S2O3•5H2O,简易实验流程如下:

(1)硫粉用乙醇润湿的目的是有利于硫粉与亚硫酸钠溶液充分接触,加快反应速率.
(2)操作中不能将溶液蒸发至干的原因是蒸干会使硫代硫酸钠晶体脱水并分解.
(3)所得粗产品一般通过重结晶方法提纯.
硫化碱法:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,主要实验装置如下:

(4)装置C的作用是吸收反应生成的CO2和多余的SO2,防止污染大气.
(5)为充分利用SO2,对装置B进行改进(如上右图所示):当A中反应发生后,关闭旋塞b、e,打开a、c、d,往B中溶液通入SO2,未反应的SO2被收集到气囊f中.待f收集到较多气体时(假定此时装置A中反应已停止),关闭旋塞ac,打开旋塞bde,轻轻挤压f,使SO2缓缓地压入B中溶液再次反应,未反应的SO2又被收集在气囊g中.再将g中的气体挤压入f中,如此反复,直至完全反应.
(6)为测定硫代硫酸钠晶体粗产品的纯度.某兴趣小组称取5.0克粗产品配成250mL溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.01mol/L KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时到达滴定终点.实验数据如下表:
| 滴定次数 | 1 | 2 | 3 |
| 消耗Na2S2O3溶液(mL) | 19.98 | 21.18 | 20.02 |
②可能造成实验结果偏低的有BD(填编号).
A.锥形瓶用蒸馏水润洗
B.滴定管未用Na2S2O3溶液润洗
C.滴定终点时俯视读数
D.若滴定前滴定管尖嘴处有气泡,滴定后消失.
| A. | 燃料电池的能量转化率可达100% | |
| B. | 充电电池可以无限制地反复放电、充电 | |
| C. | 化学能与其他形式的能相互转化的途径是化学反应 | |
| D. | 原电池把化学能直接转化为电能,所以由原电池提供的电能是一次能源 |