题目内容
【题目】向100mL0.1molL-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1molL-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。下列说法正确的( )
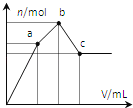
A.a点的溶液呈中性
B.a点沉淀的质量比c点沉淀的质量大
C.b点加入Ba(OH)2溶液的体积为250mL
D.至c点完成反应,反应的离子方程式可表示为:Al3++2SO42-+NH4++2Ba2++5OH-→AlO2-+2BaSO4↓+NH3H2O+2H2O
【答案】D
【解析】
100mL 0.1molL﹣1硫酸铝铵[NH4Al(SO4)2]中NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol,Al3+0.01mol,SO42-0.02mol。
开始滴加时,发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH- =Al(OH)3↓,当Al3+沉淀完全时需加入0.03mol OH-,即加入0.015mol Ba(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(开始到a)
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++ OH-=NH3H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.02mol Ba(OH)2,加入0.04mol OH-,Al3+反应掉0.03molOH﹣,生成Al(OH)30.01mol,剩余0.01molOH﹣恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;(a到b)
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH- =AlO2﹣+2H2O,由方程式可知要使0.01mol Al(OH)3完全溶解,需再加入0.005mol Ba(OH)2,此时溶液为氨水与偏铝酸钡溶液.(b到c)
A.由分析可知,从开始到a点,发生反应为SO42﹣+Ba2+=BaSO4↓,Al3++3OH﹣= Al(OH)3↓,a点对应的沉淀为BaSO4和Al(OH)3,溶液中的溶质是(NH4)2SO4,该物质水解溶液呈酸性,A错误;
B.a点沉淀的质量=0.015mol×233g/mol+0.01mol×78g/mol=4.275g,c点为硫酸钡的质量,为0.01mol×2×233g/mol=4.66g,所以质量c点>a点,B错误;
C.当SO42﹣完全沉淀时,共需加入0.02mol Ba(OH)2,则b点消耗氢氧化钡体积=![]() =0.2L=200mL,C错误;
=0.2L=200mL,C错误;
D.至c点完成反应,反应的离子方程式可表示为:Al3++2SO42﹣+NH4++2Ba2++5OH﹣=AlO2﹣+2BaSO4↓+NH3H2O+2H2O,D正确;
故选D。

 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案【题目】下表是四种盐在不同温度下的溶解度(g/100g水):(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
NaNO3 | KNO3 | NaCl | KCl | |
10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
100℃ | 175 | 246 | 39.1 | 56.6 |
用物质的量之比为1:1的硝酸钠和氯化钾为原料,制取硝酸钾晶体,其流程如图所示
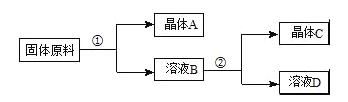
以下说法错误的是( )
A.①和②的实验过程中,都需要控制温度
B.①实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤
C.②实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤
D.用95%的酒精洗涤所得的硝酸钾晶体比较好
【题目】由下列实验及现象推出的相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 2 mL0.01mol·L-1的KI溶液中滴入等体积等浓度的FeCl3溶液,将充分反应后的溶液分三份,一份滴入K3[Fe(CN)6]溶液,第二份滴入KSCN溶液,第三份滴入淀粉溶液 | 滴入K3[Fe(CN)6]溶液后产生蓝色沉淀;滴入KSCN溶夜后变血红色;滴入淀粉溶液后溶液变蓝 | KI溶液和FeCl3溶液发生反应:2Fe3++2I- |
B | 向稀硫酸中加入铜片,然后通入氧气加热 | 先无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸>Cu2+ |
C | 向浓度均为0.1 mol·L-1的Na2SO3和Na2SiO3溶液中分别滴加酚酞 | Na2SiO3溶液红色更深 | 非金属性:Si<S |
D | 将几滴等浓度的FeCl3溶液、AlCl3溶液同时滴入足量等浓度的NaOH溶液中 | 只产生红褐色沉淀 | Ksp[Al(OH)3]>K sp[Fe(OH)3] |
A. A B. B C. C D. D
【题目】2019年诺贝尔化学奖授予美国和日本的三位科学家,以表彰他们在锂离子电池领域的贡献。某种锂离子电池的工作原理如图所示,工作原理为:LiCoO2+C6![]() Li1-xCoO2+LixC6
Li1-xCoO2+LixC6
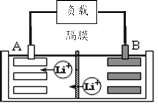
(1)该锂离子电池工作时A为____极,B的电极反应式为____。
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过实验方法回收钴、锂,实现废旧电池的资源化。
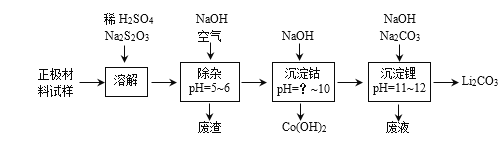
下表列出了几种离子生成氢氧化物沉淀的pH(“开始沉淀”的pH按金属离子浓度为0.1mol·L-1,“沉淀完全”是指溶液中离子浓度低于1.0×10-5 mol·L-1):
Al3+ | Fe3+ | Fe2+ | Co2+ | |
开始沉淀的pH | 4.0 | 2.7 | 7.6 | 7.0 |
沉淀完全的pH | 5.2 | 3.7 | 9.6 | ? |
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中反应的化学方程式为____。
②除杂过程中,通空气将Fe2+氧化为Fe3+的目的是____。
③沉钴过程中,须调节溶液的pH不低于____。