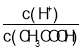题目内容
【题目】SO2是造成空气污染的主要原因之一。可以用Na2SO3溶液为吸收液除SO2。
(1)反应的离子方程式是___________。
(2)已知NaHSO3溶液显酸性,请结合离子方程式,用盐的水解和电离理论进行解释:_________________。
(3)在Na2SO3稀溶液中各离子浓度从大到小排列顺序是___________________。
(4)往Na2SO3稀溶液中加入少量KOH固体完全溶解后(忽略溶解过程中溶液温度变化)溶液中c(Na+):c(SO32-)的比值________(填“变大”、“变小”或“保持不变”)。
【答案】SO32-+SO2+H2O=2HSO3- 在亚硫酸氢钠溶液中HSO3-存在电离平衡:HSO3-![]() SO32-+H+和水解平衡HSO3-+H2O
SO32-+H+和水解平衡HSO3-+H2O![]() H2SO3+OH-,HSO3-的电离程度强于水解程度,故溶液呈酸性 c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+) 变小
H2SO3+OH-,HSO3-的电离程度强于水解程度,故溶液呈酸性 c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+) 变小
【解析】
(1)Na2SO3溶液吸收SO2能生成亚硫酸氢钠;
(2)HSO3-在溶液中既能电离出氢离子,同时HSO3-也能水解生成氢氧根,由于HSO3-的电离程度大于水解程度,所以溶液显酸性;
(3)先写出Na2SO3稀溶液中的所有的电离、水解方程式,比较电离和水解程度的大小,进而比较离子的大小顺序;
(4)利用水解平衡移动进行分析。
(1)Na2SO3溶液吸收SO2能生成亚硫酸氢钠,反应的离子方程式是SO32- + SO2 + H2O = 2HSO3-,故答案为:SO32- + SO2 + H2O = 2HSO3-;
(2)HSO3-在溶液中既能电离出氢离子HSO3- H+ + SO32-,同时HSO3-也能水解生成氢氧根, HSO3- + H2O OH- + H2SO3,由于HSO3-的电离程度大于水解程度,所以溶液显酸性,故答案为:在亚硫酸氢钠溶液中HSO3-在溶液中既能电离出氢离子,HSO3- H+ + SO32-,同时HSO3-也能水解生成氢氧根,HSO3- + H2O OH- + H2SO3,由于HSO3-的电离程度大于水解程度,所以溶液显酸性;
(3)在Na2SO3稀溶液中,按电离和水解程度的大小顺序依次排列为:Na2SO3 = 2Na+ + SO32-;SO32- + H2O OH- + HSO3-;HSO3- + H2O OH- + H2SO3,H2O OH- + H+,则Na2SO3稀溶液中各离子浓度从大到小排列顺序是c(Na+)> c(SO32-)> c(OH-)> c(HSO3-)> c(H+),故答案为:c(Na+)> c(SO32-)> c(OH-)> c(HSO3-)> c(H+);
(4)在Na2SO3稀溶液中存在SO32-的水解平衡:SO32- + H2O OH- + HSO3-,当加入少量KOH固体后,c(OH-)增大,平衡逆向移动,c(SO32-)增大,c(Na+)不变,则c(Na+) : c(SO32-) 的比值变小,故答案为:变小。

 阅读快车系列答案
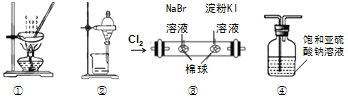
阅读快车系列答案【题目】某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:
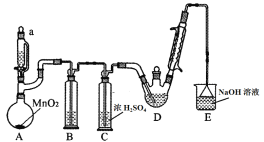
①制备反应原理: C2H5OH + 4Cl2→CCl3CHO+5HCl
可能发生的副反应:
C2H5OH + HCl→C2H5Cl+H2O
CCl3CHO + HClO→CCl3COOH (三氯乙酸) +HCl
②相关物质的部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
熔点/℃ | -1 14.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
(1)装置B中盛放的试剂是___________;装置E的作用是_______;
(2)若撤去装置C,可能导致装置D中副产物________(填化学式)的量增加;装置D可采用________加热的方法以控制反应温度在70℃左右。
(3)反应结束后,可采用_________的方法从D中的混合物分离出CCl3COOH,除酒精灯、接液管、温度计、锥形瓶外,所需玻璃仪器有_________。
(4)测定产品纯度:称取产品0.30 g配成待测溶液,加入0.1000 mol/L碘标准溶液20.00 mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.0200 mol/LNa2S2O3溶液滴定至终点。进行平行实验后,测得消耗Na2S2O3溶液20.00 mL。则产品的纯度为____。(保留3位有效数字)
滴定的反应原理:CCl3CHO +OH—→CHCl3 + HCOO- HCOO-+ I2 → H+ + 2I-+ CO2↑ I2 + 2S2O32-→2I- + S4O62-
(5)请设计实验方案证明三氯乙酸的酸性比乙酸强:________