题目内容
【题目】请按如图所示要求,完成下列实验:
实验①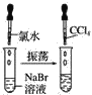
实验②
实验③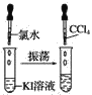
(1)实验①静置后,观察到实验现象是__,反应的化学方程式是__。
(2)实验②静置后,观察到实验现象是__,反应的化学方程式是__。
(3)实验③静置后,观察到实验现象是__,反应的化学方程式是__。
(4)通过上述实验可知,卤素单质氧化性由强到弱的顺序是__,卤素阴离子的还原性由强到弱的顺序是__。
【答案】液体分层,上层无色,下层橙红色 2NaBr+Cl2=2NaCl+Br2 液体分层,上层无色,下层紫红色 2KI+Br2=2KBr+I2 液体分层,上层无色,下层紫红色 2KI+Cl2=2KCl+I2 Cl2>Br2>I2 Cl-<Br-<I-
【解析】
(1)实验①中氯气能氧化NaBr生成NaCl和Br2;
(2)实验②中Br2能氧化KI生成KBr和I2;
(3)实验③中氯气能氧化KI生成KCl和I2;
(4)自发的氧化还原反应中氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物。
(1)实验①中氯气能氧化NaBr生成NaCl和Br2,发生反应的化学方程式是2NaBr+Cl2=2NaCl+Br2,则可观察到实验现象是液体分层,上层无色,下层橙红色;
(2)实验②中Br2能氧化KI生成KBr和I2,发生反应的化学方程式是2KI+Br2=2KBr+I2,则观察到实验现象是液体分层,上层无色,下层紫红色;
(3)实验③中氯气能氧化KI生成KCl和I2,发生反应的化学方程式是2KI+Cl2=2KCl+I2,则观察到实验现象是液体分层,上层无色,下层紫红色;
(4)由2NaBr+Cl2=2NaCl+Br2可知氧化性:Cl2>Br2,还原性:Br->Cl-;由2KI+Br2=2KBr+I2可知氧化性:Br2 >I2,还原性:I->Br-;由2KI+Cl2=2KCl+I2可知氧化性:Cl2>I2,还原性:I->Cl-;则卤素单质氧化性由强到弱的顺序是Cl2>Br2>I2,卤素阴离子的还原性由强到弱的顺序是Cl-<Br-<I-。

 名校课堂系列答案
名校课堂系列答案