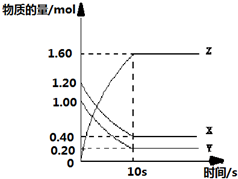
题目内容
12.0.2mol•L-1的醋酸溶液中,各种离子浓度的关系正确的是( )| A. | [CH3COOH]>[H+]>[CH3COO-]>[OH-] | B. | [H+]>[CH3COO-]>[CH3COOH]>[OH-] | ||
| C. | [CH3COOH]>[CH3COO-]>[H+]>[OH-] | D. | [CH3COOH]>[H+]>[OH-]>[CH3COO-] |
分析 醋酸为弱酸,在溶液中只能部分电离出氢离子,则[H+]>[OH-]、[CH3COOH]>[CH3COO-],根据电荷守恒可知,则[H+]>[CH3COO-],据此判断溶液中各离子浓度大小.
解答 解:0.2mol•L-1的醋酸溶液中,醋酸为弱酸,在溶液中只能部分电离出氢离子,则[H+]>[OH-]、[CH3COOH]>[CH3COO-],根据电荷守恒[H+]=[OH-]+[CH3COO-]可知:则[H+]>[CH3COO-],所以溶液中各离子浓度大小为:[CH3COOH]>[H+]>[CH3COO-]>[OH-],
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒的含义为解答关键,注意掌握弱电解质在溶液中部分电离的特点,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
9.2015年4月28日,著名物理化学家徐光宪与世长辞,他在稀土萃取领域有惊人的成就,被誉为“稀土界的袁隆平”,稀土元素铈(Ce),其金属单质在空气中易氧化;加热时,在空气中燃烧;能溶于酸,不溶于碱;常见的化合价为+3和+4,氧化性Ce4+>Fe3+.下列说法不正确的是( )
| A. | 铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ | |
| B. | 四种铈的核素${\;}_{58}^{136}$Ce、${\;}_{58}^{138}$Ce、${\;}_{58}^{142}$Ce,它们互为同位素 | |
| C. | 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ | |
| D. | 金属铈应储存于阴凉、通风的地方,包装要密封,不可与空气接触 |
6.对于2(g)A+B(g)?2C(g),△H<0,当温度升高时,平衡向逆反应方向移动,其原因是( )
| A. | 正反应速率增大,逆反应速率减小 | |
| B. | 逆反应速率增大,正反应速率减小 | |
| C. | 正、逆反应速率均增大,但是逆反应速率增大的程度大于正反应速率增大的程度 | |
| D. | 正、逆反应速率均增大,而且增大的程度一样 |
7.下列说法正确的是( )
| A. | 放热反应均是自发反应 | |
| B. | 如果△H和△S为均正值,当高温时,反应可能自发进行 | |
| C. | 物质的量增加的反应,△S为正值 | |
| D. | △S为正值的反应均是自发反应 |
17.下列事实能说明甲酸(HCOOH)是弱酸的是( )
| A. | 甲酸能与水以任意比互溶 | |
| B. | 0.1mol/L的甲酸钠溶液的pH约为9 | |
| C. | 0.1mol/L的甲酸溶液的pH约为4.8 | |
| D. | 10mL0.1mol/L的甲酸恰好能与10mL0.1mol/L的NaOH溶液完全反应 |
4.某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原HNO3的物质的量之比为2:1时,还原产物可能是( )
| A. | N2O | B. | NO | C. | NO2 | D. | N2 |
2.下列说法正确的是( )
| A. | 决定有机物种类繁多的原因是组成有机物的元素种类较多 | |
| B. | C5H12有四种同分异构体 | |
| C. | 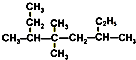 用系统命名法命名:3,4,4-三甲基-6-乙基庚烷 用系统命名法命名:3,4,4-三甲基-6-乙基庚烷 | |
| D. | 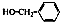 与 与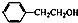 互为同系物 互为同系物 |