题目内容
7.下列说法正确的是( )| A. | 放热反应均是自发反应 | |
| B. | 如果△H和△S为均正值,当高温时,反应可能自发进行 | |
| C. | 物质的量增加的反应,△S为正值 | |
| D. | △S为正值的反应均是自发反应 |
分析 反应能否自发进行,取决于焓变与熵变的综合判据,当△H-T•△S<0时,反应可自发进行,否则不能,以此解答.
解答 解:A.放热反应不一定能发生进行,如铝热反应为放热反应,在常温下不能自发进行,故A错误;
B.如果△H和△S均为正值,当温度升高时,可满足△H-T•△S<0时,反应可自发进行,故B正确;
C.只有气体的物质的量增加的反应,△S为正值,故C错误;
D.△S为正值的反应不一定是自发反应,如水的分解,故D错误.
故选B.
点评 本题考查反应热与焓变,题目难度不大,注意把握化学反应进行的方向取决于焓变和熵变的综合判据,不能只根据一种物理量进行判断.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
3.下列说法正确的是( )
| A. | 含有共价键的物质一定是共价化合物 | |
| B. | 分子中只有共价键的化合物一定是共价化合物 | |
| C. | 离子化合物中一定没有共价键 | |
| D. | 离子化合物一定含有金属元素 |
4.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况屯的密度为0.76g•L-1;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 在上述五种元素形成的单质中,X元素可形成几种同素异形体 | |
| C. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定没有离子键 |
1.短周期元素R、T、X、Y、Z在元素周期表的相对位置如表所示,它们的最外层电子数之和为31.则下列判断正确的是( )
| R | T | |
| X | Y | Z |
| A. | R位于元素周期表中第二周期第ⅣA族 | |
| B. | 原子半径:X<R<T | |
| C. | 最简单气态氢化物稳定性:T>R>Y | |
| D. | 最高价氧化物的水化物酸性:T>R>Y |
2.现有下列十种物质:①H2;②铜;③CaO;④CO2;⑤H2SO4;⑥Ba(OH)2;
⑦红褐色的氢氧化铁液体; ⑧氨水;⑨稀硝酸;⑩Al2(SO4)3
上述各物质按物质的分类方法填写表格的空白处(填物质编号):
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-.
(4)少量的④通入⑥的溶液中反应的离子方程式为Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)②与⑨发生反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是2:3,当有3.2g Cu发生反应时,转移电子的物质的量为0.1mol.该反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
⑦红褐色的氢氧化铁液体; ⑧氨水;⑨稀硝酸;⑩Al2(SO4)3
上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 | 金属单质 | 酸性氧化物 | 碱性氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 |
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-.
(4)少量的④通入⑥的溶液中反应的离子方程式为Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)②与⑨发生反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是2:3,当有3.2g Cu发生反应时,转移电子的物质的量为0.1mol.该反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
12.0.2mol•L-1的醋酸溶液中,各种离子浓度的关系正确的是( )
| A. | [CH3COOH]>[H+]>[CH3COO-]>[OH-] | B. | [H+]>[CH3COO-]>[CH3COOH]>[OH-] | ||
| C. | [CH3COOH]>[CH3COO-]>[H+]>[OH-] | D. | [CH3COOH]>[H+]>[OH-]>[CH3COO-] |
19.在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀.已知有关物质的溶度积KSP(25℃)如下:
下列论述错误的是( )
| AgCl | Agl | Ag2S | |
| KSP(单位省略) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
| A. | 沉淀转化的实质就是沉淀溶解平衡的移动 | |
| B. | 溶解度小的沉淀可以转化为溶解度更小的沉淀 | |
| C. | AgCl固体在等物质的量浓度的NaCl、CaCl2 溶液中的溶解度相同 | |
| D. | 25℃时,在饱和AgCl、Agl、Ag2S溶液中,所含Ag+的浓度相同 |
16.下列化学用语表述正确的是( )
| A. | 一氯甲烷的结构式CH3Cl | B. | 苯的分子式C6H6 | ||
| C. | 葡萄糖的结构简式C6H12O6 | D. | 氮气的电子式 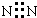 |
17.短周期元素A、B、C、D的原子序数依次增大,它们的原子序数之和为36,且原子最外层电子数之和为14;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素.下列叙述正确的是( )
| A. | 在地壳中,C元素的含量位于第一位 | |
| B. | 由B、C、D三种元素组成的盐只有两种 | |
| C. | C元素位于元素周期表中的第3周期第ⅠA族 | |
| D. | B元素与氢元素形成化合物的化学式一定为H2B |