��Ŀ����
����Ŀ�������£���20.00 mL 0.1000 mol��L��1 NH3��H2O��Һ����εμ�0.1000 mol��L��1 HCl��Һ����ҺpH�����HCl��Һ����ı仯������ͼ��ʾ������˵����ȷ����
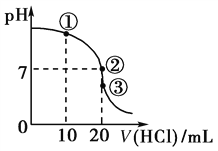
A. ����Һ��c(Cl��)>c(NH)>c(OH��)>c(H��)
B. ����Һ��c(NH)��c(Cl��)>c(OH��)��c(H��)
C. ����������������ʾ����Һ��ˮ�ĵ���̶Ȣ�>��>��
D. �ζ������в����ܳ��֣�c(NH3��H2O)>c(NH)>c(OH��)>c(Cl��)>c(H��)
���𰸡�B
���������������������Һʱ��Ũ�ȵ�NH3��H2O��NH4Cl�Ļ��Һ����Һ�ʼ��ԣ�c(NH4+)��c(Cl��)��c(OH��)��c(H��)����A��������Һ�����ԣ����ݵ���غ㣬c(NH4+)��c(Cl��)��c(OH��)��c(H��)����B��ȷ������Ϊ���ǡ�÷�Ӧ����ʱ�Ȼ��ˮ�⣬��Һ�����ԣ��ٽ�ˮ���룬����������Ϊ��ʣ�࣬����ˮ���룬����������������ʾ����Һ��ˮ�ĵ���̶���������������C����ʼ�μ�����ʱ���ܳ���c(NH3��H2O)��c(NH4+)��c(OH��)��c(Cl��)��c(H��)����D����

��ϰ��ϵ�д�
 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д� ����������ϵ�д�
����������ϵ�д�
�����Ŀ