��Ŀ����
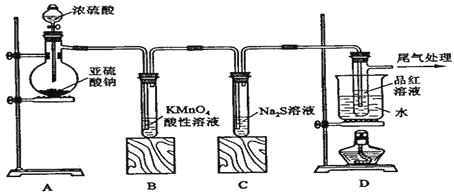
����Ŀ��ij�о���ѧϰС������ͼװ�ý���SO2��FeCl3��Һ��Ӧ�����ʵ�飺
����������
��1��������FeCl3��Һʱ�����Ȱ�FeCl3�����ܽ���________�У��ټ�ˮϡ�ͣ����ܵõ���������Һ��
��2��Bװ�õ�������__________��Dװ��������β�������ӷ���ʽ��__________��
��3��Aװ�����Ʊ�SO2�Ļ�ѧ����ʽΪ��_______���ڸ÷�Ӧ��Ũ�������ֵ�������______��
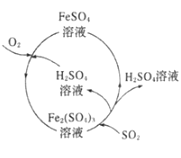
��4�����¶Ƚϸߵ�SO2���壨������ͨ��FeCl3��Һ��ʱ�����Թ۲쵽��Һ�ɻ�ɫ��Ϊdz��ɫ�����ݴ�����С��ͬѧ��ΪSO2��FeCl3��Һ������������ԭ��Ӧ��
a.д��SO2��FeCl3��Һ��Ӧ�����ӷ���ʽ��___________��
b.�����ʵ�鷽������������Ӧ��FeCl3�Ƿ�Ӧ��ȫ��_________________��
c.����õ���dz��ɫ��Һ����εμ�NaOH��Һ�����Թ۲쵽�������ǣ�________��
���𰸡�Ũ���� ������ ![]()
![]() �����ԡ����� 2Fe3++SO2+2H2O=SO42-+4H++2Fe2+ ȡ������Ӧ�����Һ���Թ��У��μ�����KSCN��Һ������Һ���ɫ��FeCl3û�з�Ӧ��ȫ ���ɰ�ɫ������Ѹ�ٱ�ɻ���ɫ�����ձ�ɺ��ɫ
�����ԡ����� 2Fe3++SO2+2H2O=SO42-+4H++2Fe2+ ȡ������Ӧ�����Һ���Թ��У��μ�����KSCN��Һ������Һ���ɫ��FeCl3û�з�Ӧ��ȫ ���ɰ�ɫ������Ѹ�ٱ�ɻ���ɫ�����ձ�ɺ��ɫ
��������
��1�������Ȼ�����Һʱ��Ӧ����Ӧ��������������ˮ�⣬���ձ���ϡ��������Һ��
��2��SO2������FeCl3��Һ����Ҫ������װ�ã�β����Ҫ��δ��Ӧ�Ķ�������
��3��Ũ�����ͭ�ۼ������������ɶ�������
��4��a�����������ӿ���������������
b�����������ӿ�����KSCN��Һ��Ӧ�Ժ�ɫ��
c���������������ױ�����������
��1���������Ȼ�����Һʱ�����Ȱ��Ȼ��������ܽ���Ũ�����У��ټ�ˮϡ�ͣ�����������Ŀ��������������ˮ�⣬�ʴ�Ϊ��Ũ���
��2��SO2������FeCl3��Һ����Ҫ������װ�ã����������������������ӷ�Ӧ����ʽΪ��![]() ���ʴ�Ϊ����������
���ʴ�Ϊ����������![]() ��
��
��3���Ʊ�SO2�Ļ�ѧ����ʽΪ��![]() ���÷�Ӧ��������Ũ������������������������ԣ��ʴ�Ϊ��
���÷�Ӧ��������Ũ������������������������ԣ��ʴ�Ϊ��![]() �������ԡ����ԣ�
�������ԡ����ԣ�
��4��a�����������ӿ��������������ʴ�Ϊ��2Fe3++SO2+2H2O=SO42-+4H++2Fe2+ 2Fe3++SO2+2H2O=SO42-+4H++2Fe2+��
b��ʵ���ҳ���KSCN�������������ӣ��ʴ�Ϊ��ȡ������Ӧ�����Һ���Թ��У��μ�����KSCN��Һ������Һ���ɫ��FeCl3û�з�Ӧ��ȫ��
c������õ���dz��ɫ��Һ����εμ�NaOH��Һ�������������������������ױ������������ʴ�Ϊ�����ɰ�ɫ������Ѹ�ٱ�ɻ���ɫ�����ձ�ɺ��ɫ��

 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�����Ŀ������̿��ԭ��Ҳ���Դ������������ij�ܱ������м��������Ļ���̿��һ����NO��������ӦC(s) + 2NO(g)![]() N2(g) + CO2(g) + Q��Q��0������T1��ʱ����Ӧ���е���ͬʱ�䣬��������ڸ����ʵ����ʵ���Ũ�����£�
N2(g) + CO2(g) + Q��Q��0������T1��ʱ����Ӧ���е���ͬʱ�䣬��������ڸ����ʵ����ʵ���Ũ�����£�
ʱ�� /min | 0 | 10 | 20 | 30 | 40 | 50 | |
Ũ�� /mol��L-1 | NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 | |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 | |
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ________��0-10 min��NO��ƽ����Ӧ����Ϊ____________��
��30 min��ֻ�ı�ijһ���������ݱ��������жϸı������������__________����Ӧ�أ�ƽ��__��ѡ���ţ���
a��������Ӧ�����ƶ� b�����淴Ӧ�����ƶ� c���������ƶ�