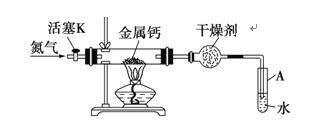
��Ŀ����
����Ŀ��25��ʱ����һ��Ũ�ȵ�Na2X��Һ�е������ᣬ��Һ��pH������Ũ�ȱ仯��ϵ��ͼ��ʾ��

��֪��H2X�Ƕ�Ԫ���ᣬY��ʾ![]() ��
��![]() ��pY����lgY��������������ȷ���ǣ�������
��pY����lgY��������������ȷ���ǣ�������
A. ����n��ʾpH��p![]() �ı仯��ϵ
�ı仯��ϵ
B. Ka2��H2X����1.0��10��10.3
C. NaHX��Һ��c��H+����c��OH����
D. ����Һ������ʱ��c��Na+����c��HX����+2c��X2����+c��Cl����
���𰸡�C
��������
H2XΪ��Ԫ���ᣬ�Ե�һ������Ϊ������Ka1��H2X����Ka2��H2X������pH��ͬʱ![]() ��
��![]() ��pY����lgY����p
��pY����lgY����p![]() ��p
��p![]() ����m��n�ֱ��ʾpH��p
����m��n�ֱ��ʾpH��p![]() ��p
��p![]() �ı仯��ϵ��
�ı仯��ϵ��
A�����ݷ�����֪��n��ʾpH��p![]() �ı仯��ϵ����A���������⣻
�ı仯��ϵ����A���������⣻
B��M��pH��9.3��c��H+����10��9.3mol/L��p![]() ����lg
����lg![]() ��1����
��1����![]() ��0.1������Ka2��H2X����
��0.1������Ka2��H2X����![]() ��c��H+����10��9.3��0.1��1.0��10��10.3����B���������⣻
��c��H+����10��9.3��0.1��1.0��10��10.3����B���������⣻
C������B��֪HX���ĵ���ƽ�ⳣ��Ϊ1.0��10��10.3������n��ʾpH��p![]() �ı仯��ϵ��n��pH��7.4��p
�ı仯��ϵ��n��pH��7.4��p![]() ����lg
����lg![]() ����1��
����1��![]() ��10������HX����ˮ��ƽ�ⳣ��Kh��
��10������HX����ˮ��ƽ�ⳣ��Kh��![]() ��
��![]() ��
��![]() ��1.0��10��7.6��1.0��10��10.3��˵��HX����ˮ��̶ȴ��������̶ȣ���NaHX��Һ��Һ�ʼ��ԣ�c��H+����c��OH��������C�������⣻
��1.0��10��7.6��1.0��10��10.3��˵��HX����ˮ��̶ȴ��������̶ȣ���NaHX��Һ��Һ�ʼ��ԣ�c��H+����c��OH��������C�������⣻
D������Һ������ʱ��c��H+����c��OH���������ݵ���غ��֪��c��Na+����c��HX����+2c��X2����+c��Cl��������D���������⣻
�𰸣�C��

 ��У����ϵ�д�
��У����ϵ�д�