题目内容
【题目】氨是一种重要的化工产品,也是重要的化工原料。某化学小组在实验室制备氨并完成相关性质实验。
(1)实验一:用如图所示装置制备并收集 NH3。
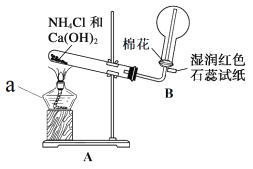
仪器 a 的名称为____________,装置 A 中产生 NH3 的化学方程式为____________, 装置 B 中用圆底烧瓶收集 NH3 的方法为____________(填“向上排空气法”或“向下 排空气法”),当湿润红色石蕊试纸颜色变为____________色,表示已经收集满 NH3。
(2)实验二:用如图所示装置进行 NH3 的喷泉实验。
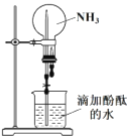
引发该喷泉实验的操作是先____________,再打开止水夹,使烧杯内的水通过导管进入烧瓶形成喷泉,说明 NH3 具有的物理性质是____________,烧瓶内溶液呈红色, 说明 NH3 的水溶液呈____________性。
【答案】酒精灯 Ca(OH)2 + 2NH4Cl= CaCl2+ 2NH3↑+ 2H2O 向下排空气法 蓝 挤压胶头滴管,将水挤入烧瓶 极易溶解于水 碱
【解析】
(1) 仪器 a 的名称为酒精灯,答案为酒精灯
装置 A 中产生 NH3 的化学方程式为:Ca(OH)2 + 2NH4Cl![]() CaCl2+ 2NH3↑+ 2H2O
CaCl2+ 2NH3↑+ 2H2O
答案为:Ca(OH)2 + 2NH4Cl![]() CaCl2+ 2NH3↑+ 2H2O
CaCl2+ 2NH3↑+ 2H2O
装置 B 中所用圆底烧瓶口向下,所以收集NH3的方法为向下排空气法。
答案为:向下排空气法
氨气溶于水后,所得溶液显碱性,能使湿润的红色石蕊试纸颜色变蓝色。所以当湿润红色石蕊试纸颜色变为蓝色时,表示已经收集满NH3。答案为:蓝
(2)引发喷泉的方法是设法减小烧瓶内气体的压强,所以可采用水溶减压法,即挤压胶头,让水进入烧瓶,氨气溶于水导致烧瓶内气体压强减小。
答案为:挤压胶头滴管,将水挤入烧瓶
打开止水夹,使烧杯内的水通过导管进入烧瓶形成喷泉,说明 NH3 具有的物理性质是极易溶于水。答案为:极易溶解于水
烧瓶内溶液呈红色, 说明NH3的水溶液呈碱性。答案为碱

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案