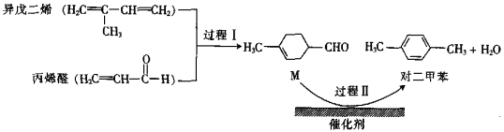
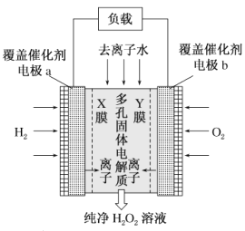
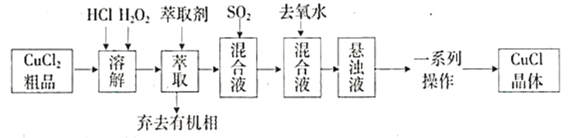
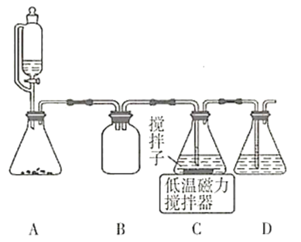
题目内容
【题目】羟氨![]() 在水溶液中的电离方程式为:
在水溶液中的电离方程式为:![]() ,用0.1mol/L盐酸滴定20mL 0.1mol/L
,用0.1mol/L盐酸滴定20mL 0.1mol/L![]() 溶液,恒定25℃时,滴定过程中由水电离出来的OHˉ浓度的负对数与盐酸体积的关系如图所示,下列说法错误的是( )
溶液,恒定25℃时,滴定过程中由水电离出来的OHˉ浓度的负对数与盐酸体积的关系如图所示,下列说法错误的是( )

A.B点对应的溶液中![]()
B.C点对应的溶液中![]()
C.A到C溶液中,![]() 电离常数不变
电离常数不变
D.由A到D,水电离出的![]() 先减小后增大
先减小后增大
【答案】D
【解析】
根据NH2OH在水溶液中的电离方程式可知,滴入盐酸时发生反应NH2OH+HCl=[NH3OH]Cl;水电离出的OHˉ的浓度即为水的电离程度,酸或碱的电离抑制水的电离,盐类的水解促进水的电离,所以HCl和NH2OH恰好完全反应,溶液中的溶质为[NH3OH]Cl时,水的电离程度达到最大,即C点。
A.B点溶液中存在电荷守恒:c(Clˉ)+c(OHˉ)=c(NH3OH+)+c(H+),此时溶液显中性,所以c(OHˉ)= c(H+),所以c(Clˉ)= c(NH3OH+),故A正确;
B.C点HCl和NH2OH恰好完全反应,此时溶液中的溶质为[NH3OH]Cl,根据质子守恒可知c(H+)= c(OHˉ)+ c(NH2OH),故B正确;
C.电离常数只与温度有关,温度不变则电离常数不变,故C正确;
D.据图可知由A到D,水电离出来的OHˉ浓度的负对数先减小后增大,所以水电离出的氢氧根浓度先增大后减小,故D错误;
故答案为D。

【题目】X、Y、Z、W四种元素在周期表中的位置如图所示,其中X的简单氢化物水溶液呈碱性。下列叙述中错误的是( )
X | Y | |
Z | W |
A.原子半径:![]()
B.Y和W的最高正价都是+6
C.元素X比元素Z的非金属性强
D.X和Y两种元素能形成多种化合物
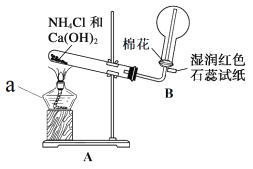
【题目】如图利用培养皿探究氨气的性质,实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面。下表中对实验现象的描述及所做的解释均正确的是
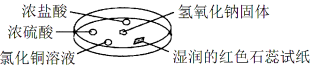
选项 | 实 验 现 象 | 解 释 |
A | 浓盐酸附近产生白烟 | NH3与HCl反应生成了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化铜溶液变白色浑浊 | 白色浑浊的成分是Cu(OH)2 |
D | 湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |