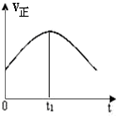
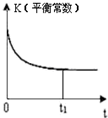
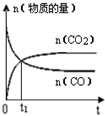
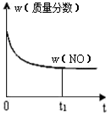
题目内容
1.A是一种常见的单质.B.C为常见的化合物.A.B.C均含有元素X.它们有如图所示转化关系(部分产物及反应条件已略去)下列有关推断正确的是( )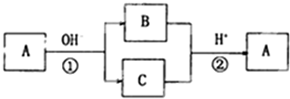
a.X元素为Al;
b.反应①和反应②互为可逆反应;
c.A可能是S或Cl2;
d.反应①和反应②一定是氧化还原反应.
| A. | a和b | B. | c和d | C. | a、b、c、d | D. | b、c、d |
分析 由转化关系图可以看出,A这种单质与强碱发生反应,生成了两种产物B和C,而且B和C均含有同一种元素,且B和C又可以在强酸的作用下发生反应,生成单质A,那么可以看出反应1应该是A物质的歧化反应,反应2应该是关于一种元素的归中反应,则可以知道B和C中应该分别含有A的负价态物质以及正价态物质,则A可能为Cl2或S,应为非金属元素.
解答 解:a.A单质在碱性条件下发生反应生成B和C两种化合物,发生了氧化还原反应,化合价既升高又降低,存在负化合价,应为非金属元素,金属元素不存在负价,故a错误;
b.可逆反应的定义是指在同一条件下,既能向正反应方向进行,同时又能向逆反应的方向进行的反应,叫做可逆反应,上述①②两个反应的反应条件不相同,不是可逆反应,故b错误;
c.如A为Cl2,在碱性条件下反应生成Cl-和ClO-,二者在酸性条件下可生成Cl2,符合框图转化关系,如A为S,在碱性条件下反应生成S2-和SO32-,二者在酸性条件下可生成S,符合框图转化关系,故c正确;
d.单质A生成化合物,元素的化合价发生变化,化合物生成A单质,化合价了发生变化,所以反应①和反应②一定属于氧化还原反应,故d正确,所以正确的是c和d,
故选B.
点评 本题考查了元素化合物的性质推断,主要考查非金属元素的歧化反应和归中反应的特征应用,关键是理解金属无负价,题目难度中等.

练习册系列答案
相关题目
11.某温度下,向pH=6的纯水中加入一定量的氢氯酸,保持温度不变,测得溶液的pH=3,对于该溶液,下列叙述中不正确的是( )
| A. | pH=6的纯水呈中性 | |
| B. | 该溶液的浓度c(HCl)=0.001 mol•L-1 | |
| C. | 该溶液中水电离产生的c(H+)=10-9 mol•L-1 | |
| D. | 该温度下,加入等体积的pH=11NaOH溶液,即可恰好完全中和 |
12.下列有关叙述中不正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温材料的元素 | |
| C. | 在金属元素区域中可以寻找制备新型农药材料的元素 | |
| D. | 23592U可用作核反应堆的燃料,21H与31H可用作制造氢弹的原料 |
9.电解Na2SO4溶液产生H2SO4和烧碱的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)( )
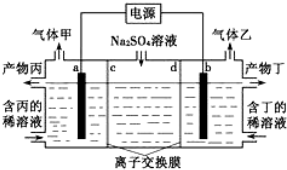

| A. | a电极反应式:2H++2e-=H2↑ | |
| B. | 产物丁为NaOH | |
| C. | c为阳离子交换膜 | |
| D. | 每转移0.2mol电子,产生1.12L气体甲 |
16.下列有关各实验的叙述中正确的是( )
| A. | 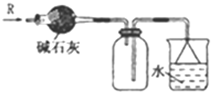 可用于SO2气体的干燥,收集并吸收多余SO2气体,防止SO2逸出污染空气并防止倒吸 可用于SO2气体的干燥,收集并吸收多余SO2气体,防止SO2逸出污染空气并防止倒吸 | |
| B. | 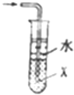 当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 | |
| C. |  进行H2,NH3,CO2,Cl,HCl,NO2等气体收集,但不能用于NO气体收集 进行H2,NH3,CO2,Cl,HCl,NO2等气体收集,但不能用于NO气体收集 | |
| D. | 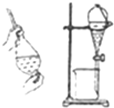 利用氯仿(CHCl3)密度大于乙醇,进行氯仿与乙醇混合物的分离 利用氯仿(CHCl3)密度大于乙醇,进行氯仿与乙醇混合物的分离 |
6.某有机物结构简式如图所示,下列有关该有机物叙述正确的是( )
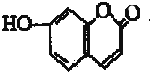

| A. | 该有机物分子式为C9H8O3 | |
| B. | 该有机物最多可以和4mol氢气发生反应 | |
| C. | 1 mo1该有机物与溴水反应,最多消耗2 mol Br2 | |
| D. | 1 mol该有机物最多与2 mol NaOH反应 |
10.根据下表中有关短周期元素性质的数据,判断下列说法中正确的是( )
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
| 化合价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 负价 | -2 | -3 | -1 | -3 | |||||
| A. | 电负性的大小:⑥<②<④<⑤ | |
| B. | 单质熔点的高低:②<⑥ | |
| C. | 第一电离能的大小:③<⑧<⑦<① | |
| D. | 最高价氧化物对应水化物的酸性强弱:④<⑤<⑦ |
 A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空: