题目内容
18.下列各项表达式中正确的是( )| A. | Na原子简化的核外电子排布式:[Na]3s1 | |
| B. | Cr原子的价电子排布式:3d54s1 | |
| C. | NH4Cl的电子式: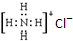 | |
| D. | Fe原子的结构示意图: |
分析 A.Na核外有11个电子,根据构造原理书写;
B.Cr核外有24个电子,根据构造原理书写;
C.NH4Cl为离子化合物,复杂阳离子和阴离子均需要括号;
D.Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2.
解答 解:A.Na核外有11个电子,根据构造原理书写,Na原子简化的核外电子排布式:[Ne]3s1,故A错误;
B.Cr核外有24个电子,根据构造原理书写,Cr原子简化的核外电子排布式:[Ar]3d54s1,价电子排布式:3d54s1,故B正确;
C.NH4Cl为离子化合物,由氨根离子与氯离子构成,电子式为: ,故C错误;
,故C错误;
D.Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,Fe原子的结构示意图: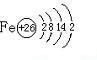 ,故D错误;
,故D错误;
故选B.
点评 本题考查了电子式、电子排布式、原子结构示意图的书写,题目难度中等,注意知识的积累.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
8.下列比较错误的是( )
| A. | 金属性:Na>Mg>Al | B. | 非金属性:Cl>S>P>Si | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 酸性:HClO>H2SO3>H3PO4>H4SiO4 |
9.电解Na2SO4溶液产生H2SO4和烧碱的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)( )
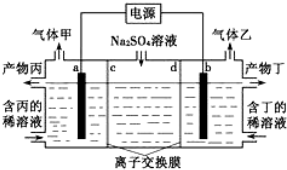

| A. | a电极反应式:2H++2e-=H2↑ | |
| B. | 产物丁为NaOH | |
| C. | c为阳离子交换膜 | |
| D. | 每转移0.2mol电子,产生1.12L气体甲 |
6.某有机物结构简式如图所示,下列有关该有机物叙述正确的是( )
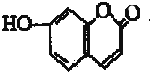

| A. | 该有机物分子式为C9H8O3 | |
| B. | 该有机物最多可以和4mol氢气发生反应 | |
| C. | 1 mo1该有机物与溴水反应,最多消耗2 mol Br2 | |
| D. | 1 mol该有机物最多与2 mol NaOH反应 |
3.下列对元素周期表和元素周期律的认识正确的是( )
| A. | d区元素全部是金属元素 | B. | 第IA元素从上到下熔沸点依次降低 | ||
| C. | 短周期元素从左到右I1依次增大 | D. | 电负性最大的元素是He |
10.根据下表中有关短周期元素性质的数据,判断下列说法中正确的是( )
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
| 化合价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 负价 | -2 | -3 | -1 | -3 | |||||
| A. | 电负性的大小:⑥<②<④<⑤ | |
| B. | 单质熔点的高低:②<⑥ | |
| C. | 第一电离能的大小:③<⑧<⑦<① | |
| D. | 最高价氧化物对应水化物的酸性强弱:④<⑤<⑦ |
7.把新制的Cu(OH)2悬浊液加入到某病人的尿液中并微热,如果观察到红色沉淀,说明尿液中可能含有的物质是( )
| A. | 食醋 | B. | 白酒 | C. | 食盐 | D. | 葡萄糖 |
14.已知:pAg=-lg[c(Ag-)],Kφ(AgCl)>Kφ(AgI).如图是某温度下向10mLAgNO3溶液中逐滴加入0.1mol•L-1的NaCl溶液中时,溶液的pAg随着加入NaCl溶液的体积变化的图象(曲线①).下列根据图象所得结论不正确的是(溶液混合时体积变化忽略不计)( )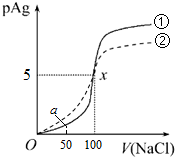

| A. | 原AgNO3溶液的物质的量浓度为1mol•L-1 | |
| B. | Kφ(AgCl)=1×10-10 | |
| C. | a点时,溶液中c(Cl-)=1.2×10-9mol•L-1 | |
| D. | 若把0.1mol•L-1的NaCl溶液换成0.1mol•L-1的NaI溶液,则pAg的变化图象变成曲线② |
 A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空: