题目内容
【题目】常温下,用0.1000molL-1NaOH溶液分别滴定20.00mL浓度均为0.1000molL-1CH3COOH溶液和HCN溶液,所得滴定曲线如图。下列说法不正确的是( )
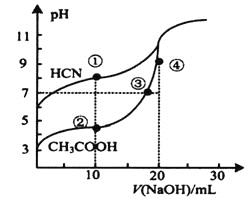
A.点①时:c(HCN)>c(Na+)>c(CN-)>c(OH-)
B.点②时:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-)
C.c(CH3COOH)+c(CH3COO-)+c(Na+)的值:③点等于④点
D.恰好完全中和时,将两种溶液混合后:c(HCN)+c(CH3COOH)>c(OH-)-c(H+)
【答案】D
【解析】
A. 点![]() 时,滴加NaOH溶液的体积为10mL,对于HCN溶液,恰好生成
时,滴加NaOH溶液的体积为10mL,对于HCN溶液,恰好生成![]() :
:![]() :1,由于溶液呈碱性,因此
:1,由于溶液呈碱性,因此![]() 的水解程度大于HCN的电离程度,则
的水解程度大于HCN的电离程度,则![]() ,故A说法正确;
,故A说法正确;
B. 点![]() 时滴加NaOH溶液的体积为10mL,反应后溶质为等浓度的醋酸和醋酸钠,根据电荷守恒
时滴加NaOH溶液的体积为10mL,反应后溶质为等浓度的醋酸和醋酸钠,根据电荷守恒![]() 和物料守恒
和物料守恒![]() 可得:
可得:![]() ,故B说法正确;
,故B说法正确;
C. ![]() 点溶液显中性,根据电荷守恒,推出
点溶液显中性,根据电荷守恒,推出![]() ,则
,则![]() 点溶液中
点溶液中![]() ,
,![]() 点二者恰好反应,根据物料守恒可知
点二者恰好反应,根据物料守恒可知![]() ,因此溶液中
,因此溶液中![]() 的值为
的值为![]() ,由于溶液中
,由于溶液中![]() 浓度均远大于
浓度均远大于![]() 浓度,所以
浓度,所以![]() 的值约等于
的值约等于![]() ,即
,即![]() 点近似等于
点近似等于![]() 点,故C说法正确,
点,故C说法正确,
D. 恰好中和时反应后溶质为等物质量的NaCN和![]() ,根据物料守恒得:
,根据物料守恒得:![]() ,混合液中满足电荷守恒:
,混合液中满足电荷守恒:![]() ,二者结合可得:
,二者结合可得:![]() ,故D说法错误。
,故D说法错误。
答案:D。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】(一)将AgCl溶于水形成饱和溶液
(1)写出沉淀溶解平衡方程式___________________________________, 写出AgCl的Ksp表达式________________________________________
(2)若向该饱和溶液中加入NaCl固体,则C(Ag+)_____(填“增大”或“减少”
(二)常温下,有浓度均为0.1molL-1的下列4种溶液:
①NaCN溶液②NaOH溶液③CH3COONa溶液④NaHCO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH最小的是______(填序号);
(2)①中各离子浓度由大到小的顺序是_______________________;
(3)④的水解方程式为______________________________________;它的水解平衡常数经过计算为______;
(4)25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)和c(CN-)之比为____________,向NaCN溶液中通入少量CO2,则发生反应的离子方程式为_____________________________________________。