题目内容
【题目】下列措施能够使水的离子积常数增大的是( )
A.温度不变,加入一定量的硫酸B.温度不变,加入一定量的NaOH
C.升高温度D.降低温度
【答案】C
【解析】
A.温度不变向水中加入H2SO4溶液,溶液中c(H+)增大,c(OH-)减小,水的离子积常数KW= c(H+)![]() c(OH-)不变,故A不符合题意;
c(OH-)不变,故A不符合题意;
B.温度不变向水中加入NaOH,溶液中c(OH-)增大,c(H+)减小,水的离子积常数KW= c(H+)![]() c(OH-)不变,故B不符合题意;
c(OH-)不变,故B不符合题意;
C.水的电离是吸热过程,升高温度,平衡向电离方向移动,c(OH-)增大,c(H+)增大,KW= c(H+)![]() c(OH-)增大,故C符合题意;
c(OH-)增大,故C符合题意;
D.水的电离是吸热过程,降低温度,平衡逆向移动,c(OH-)减小,c(H+)减小,KW= c(H+) ![]() c(OH-)减小,故D不符合题意;
c(OH-)减小,故D不符合题意;
所以答案:C。

 巧学巧练系列答案
巧学巧练系列答案【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.008 mol·L-1
D. 反应开始时,乙中的反应速率最快,甲中的反应速率最慢
【题目】人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系![]() 即为:
即为:![]() 。下列判断正确的是( )
。下列判断正确的是( )
A.正常人血液内![]()
B.人体血液里碳酸氢盐缓冲体系主要是维持血液中![]() 和
和![]() 的平衡
的平衡
C.血液中![]() 的电离方程式为:
的电离方程式为:![]()
D.正常人血液中存在:![]()
【题目】已知H2O2分解速率受多种因素影响,某小组对此进行探究,得到如下结果。下列说法不正确的是
序号 | H2O2体积(ml) | FeCl3体积(ml) | 混合溶液pH | 纯H2O2pH | 分解完全时间(s) |
1 | 20 | 10 | 1.00 | 2.92 | 几乎不分解 |
2 | 20 | 10 | 2.92 | 2.92 | 202 |
3 | 20 | 10 | 7.50 | 2.92 | 192 |
4 | 20 | 10 | 9.50 | 2.92 | 139 |
5 | 20 | 10 | 10.50 | 2.92 | 77 |
表1 (200C) | |||||
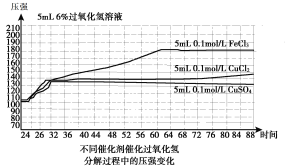
图1(200C)
A.表1表明,其他条件相同时,碱性条件下H2O2分解速率快于酸性条件下
B.图1表明,其他条件相同时,铜盐对H2O2分解的催化效果好于铁盐
C.图1表明,其他条件相同时,CuCl2对H2O2分解的催化效果好于CuSO4
D.以上实验表明,催化剂、溶液酸碱性对H2O2分解速率都有影响
【题目】(一)将AgCl溶于水形成饱和溶液
(1)写出沉淀溶解平衡方程式___________________________________, 写出AgCl的Ksp表达式________________________________________
(2)若向该饱和溶液中加入NaCl固体,则C(Ag+)_____(填“增大”或“减少”
(二)常温下,有浓度均为0.1molL-1的下列4种溶液:
①NaCN溶液②NaOH溶液③CH3COONa溶液④NaHCO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH最小的是______(填序号);
(2)①中各离子浓度由大到小的顺序是_______________________;
(3)④的水解方程式为______________________________________;它的水解平衡常数经过计算为______;
(4)25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)和c(CN-)之比为____________,向NaCN溶液中通入少量CO2,则发生反应的离子方程式为_____________________________________________。
