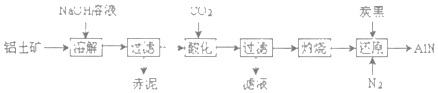
题目内容
【题目】三元电池成为2019年我国电动汽车的新能源,其电极材料可表示为![]() +3
+3![]() ,且x+y+z=1。充电时电池总反应为LiNixCoyMnzO2+6C(石墨)===Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
,且x+y+z=1。充电时电池总反应为LiNixCoyMnzO2+6C(石墨)===Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
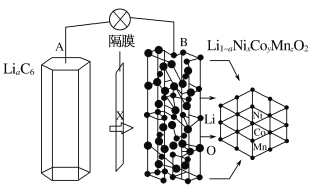
A.允许离子X通过的隔膜属于阴离子交换膜
B.充电时,A为阴极,Li+被氧化
C.可从无法充电的废旧电池的石墨电极中回收金属锂
D.放电时,正极反应式为Li1-aNixCoyMnzO2+aLi++ae-===LiNixCoyMnzO2
【答案】D
【解析】
A.根据LiNixCoyMnzO2+6C(石墨)===Li1-aNixCoyMnzO2+LiaC6可知,x是Li+,允许Li+通过的隔膜属于阳离子交换膜,A错误;
B.根据充电时电池总反应LiNixCoyMnzO2+6C(石墨)===Li1-aNixCoyMnzO2+LiaC6可知,A上发生C(石墨)→LiaC6的反应,是还原反应,A为阴极,Li+没有发生氧化还原反应,B错误;
C.根据充电时电池总反应可知,无法充电的废旧电池的石墨电极中没有锂元素,不能回收金属锂,C错误;
D.放电时,总反应为Li1-aNixCoyMnzO2+LiaC6===LiNixCoyMnzO2+6C(石墨),正极发生还原反应,电极反应式为Li1-aNixCoyMnzO2+aLi++ae-===LiNixCoyMnzO2,D正确;
答案选D。

练习册系列答案
相关题目