题目内容
【题目】在25℃时,向20.00mL0.10mol/L一元弱碱MOH溶液中滴0.10mol/LHCl溶液,混合溶液的pH、pOH变化曲线如图所示。已知pOH=-lgc(OH-)。下列说法错误的是( )
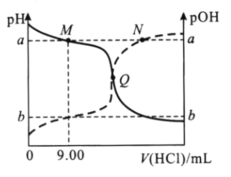
A.a+b=14
B.Q点消耗盐酸的体积小于20.00mL
C.M点和N点溶液中,![]() 相等
相等
D.当V(HCl)=10.00mL时,c(M+)-c(MOH)=c(OH-)-c(H+)
【答案】D
【解析】
A.c(H+)=10-pH=10-a时,c(OH-)=10-pOH=10-b,25℃时,c(H+)c(OH-)=10-pH×10-pOH=10-14=10-a×10-b,则a+b=14,故A正确;
B.MOH为弱碱,如果滴加盐酸20mL,恰好生成MCl,溶液显酸性,而Q点pH=pOH,此时溶液显中性,则消耗盐酸的体积小于20.00mL,故B正确;
C.![]() =
=![]() =
=![]() ,其中温度不变,Kw和Kb是定值,则M点和N点溶液中,
,其中温度不变,Kw和Kb是定值,则M点和N点溶液中,![]() 相等,故C正确;
相等,故C正确;
D.当V(HCl)=10.00mL时,溶液中溶质为MCl和MOH且等物质的量浓度,且c(MOH)<c(Cl-),已知溶液中存在的电荷守恒为c(M+)+ c(H+) =c(OH-)+c(Cl-),则c(OH-)-c(H+)= c(M+)- c(Cl-)<c(M+)-c(MOH),故D错误;
故答案为D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目



