题目内容
16.设NA为阿伏加德罗常数,下列叙述正确的是(相对原子质量O-16 Na-23)( )| A. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 100 mL 1 mol•L-1的H2SO4溶液中含有0.1NA个H+ | |
| C. | 将4 g NaOH溶于100 g蒸馏水中,所得溶液物质的量浓度是0.1 mol•L-1 | |
| D. | 20g重水(D2O)所含的电子数为10NA |
分析 A、依据体积和氢氧根离子浓度计算物质的量;
B、H2SO4~2H+;
C、溶液的体积不是0.1L;
D、20g重水(D2O)所含的电子的物质的量:$\frac{20g}{20g/mol}×10$=10mol,再求电子数目.
解答 解:A、pH=13的1.0LBa(OH)2溶液中,水也能电离出氢氧根离子,所以含有的OH-数目大于0.2NA,故A错误;
B、H2SO4~2H+,100 mL 1 mol•L-1的H2SO4溶液中含有0.2NA个H+,故B错误;
C、将4 g NaOH溶于100 g蒸馏水中,此时溶液的体积不是0.1L,故C错误;
D、20g重水(D2O)所含的电子的物质的量:$\frac{20g}{20g/mol}×10$=10mol,电子数为10NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的应用,质量换算物质的量计算微粒数,溶液中的离子物质的量计算.

练习册系列答案
相关题目
6.X、Y、Z为原子序数由小到大排列的三种短周期元素.已知:X、Y的气态氢化物分子具有相同的电数;Y与Z同主族;XY2是非极性分子,其晶体可用作人工降雨.请回答:
(1)Z的最高价氧化物对应水化物W是重要的化工原料.W的化学式为H2SO4;工业制造W的生产过程主要分为三个阶段.
①101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式S(s)+O2(g)=SO2(g)△H=-297kJ/mol;
②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压.从表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择适合的温度和压强是(选填字母)B;
A.400℃~500℃10MPa B.400℃~500℃1MPa
C.500℃~500℃10MPa D.400℃~500℃0.1MPa
③在吸收阶段,为尽可能提高ZY3的吸收效率,工业上选择的吸收剂是(选填字母)C.
A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(2)已知X与XY都是工业上常用的还原剂.
①写出X单质与W的浓溶液反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
②500℃,11.2L(标准状况)ZY2在催化剂作用下与XY发生化学反应.若有2×6.02×1023个电子转移时,该反应的化学方程式是SO2+2CO$\frac{\underline{催化剂}}{△}$S+2CO2.
(1)Z的最高价氧化物对应水化物W是重要的化工原料.W的化学式为H2SO4;工业制造W的生产过程主要分为三个阶段.
①101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式S(s)+O2(g)=SO2(g)△H=-297kJ/mol;
②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压.从表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择适合的温度和压强是(选填字母)B;
A.400℃~500℃10MPa B.400℃~500℃1MPa
C.500℃~500℃10MPa D.400℃~500℃0.1MPa
压强/MPa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(2)已知X与XY都是工业上常用的还原剂.
①写出X单质与W的浓溶液反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
②500℃,11.2L(标准状况)ZY2在催化剂作用下与XY发生化学反应.若有2×6.02×1023个电子转移时,该反应的化学方程式是SO2+2CO$\frac{\underline{催化剂}}{△}$S+2CO2.
4.下列说法正确的是( )
| A. | 油脂水解可得到氨基酸和甘油 | |
| B. | 防腐剂都有一定的毒性,所以不能吃含防腐剂的食品 | |
| C. | 蛋白质溶液、淀粉溶液都属胶体 | |
| D. | 玻璃钢是新型的无机非金属材料 |
11.下列不能用来鉴别乙烷和乙烯的方法是( )
| 选项 | 试剂或操作 | 鉴别方法 |
| A | 点燃 | 观察火焰 |
| B | 酸性高锰酸钾溶液 | 观察溶液颜色变化 |
| C | 水 | 观察水溶液 |
| D | 溴的四氯化碳溶液 | 观察溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
1.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
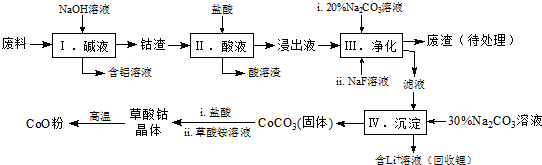
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15;废渣中的主要成分除了LiF外,还有Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低滤液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
①加热到210℃时,固体质量减轻的原因是失去结晶水.
②经测定,加热到210~290℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:3CoC2O4+2O2 Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].
Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15;废渣中的主要成分除了LiF外,还有Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低滤液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
②经测定,加热到210~290℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:3CoC2O4+2O2
 Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].
Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].
8.常温下,下列溶液中说法正确的是( )
| A. | 0.2mol•L-1氨水中滴入0.2mol•L-1CH3COOH溶液可能存在:c(NH4+)-(CH3COO-)>c(OH-)-c(H+) | |
| B. | pH=5.6的NaHSO3溶液:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) | |
| C. | 向BaSO4悬浊液中加入Na2SO4固体,Ksp(BaSO4)变小 | |
| D. | 若pOH=-lgc(OH-),则pH=3的盐酸与pOH=3的氨水等体积混合溶液,PH>7 |
5.下列指定反应的离子方程式正确的是( )
| A. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| B. | NH4Al(SO4)2溶液与过量稀氨水反应:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 用稀硝酸清洗试管内壁的银镜:Ag+2H++NO3-=Ag++NO2↑+H2O | |
| D. | FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
1.X、Y代表两种非金属元素,下列不能说明非金属性X比Y强的是( )
| A. | Y的阴离子Y 2-的还原性强于X的阴离子X- | |
| B. | X的含氧酸的酸性比Y的含氧酸的酸性强 | |
| C. | X的单质X2能将Y的阴离子Y 2-氧化,并发生置换反应 | |
| D. | X的氢化物比Y的氢化物稳定 |
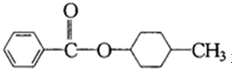 或
或 或
或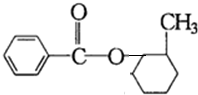 ;
; .
.