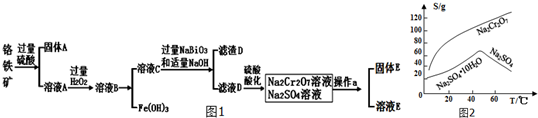
题目内容
1.X、Y代表两种非金属元素,下列不能说明非金属性X比Y强的是( )| A. | Y的阴离子Y 2-的还原性强于X的阴离子X- | |
| B. | X的含氧酸的酸性比Y的含氧酸的酸性强 | |
| C. | X的单质X2能将Y的阴离子Y 2-氧化,并发生置换反应 | |
| D. | X的氢化物比Y的氢化物稳定 |
分析 A.元素的非金属性越强,对应的阴离子的还原性越弱;
B.元素的非金属性越强,对应的最高价含氧酸的酸性越强;
C.元素的非金属性越强,对应的单质的氧化性越强,能置换出氧化性较弱的单质;
D.元素的非金属性越强,对应的氢化物越稳定.
解答 解:A.元素的非金属性越强,对应的阴离子的还原性越弱,Y的阴离子Y2-的还原性强于X的阴离子X-,则非金属性:X>Y,故A正确;
B.元素的非金属性越强,对应的最高价含氧酸的酸性越强,X的含氧酸的酸性比Y的含氧酸的酸性强,但不一定是最高价含氧酸,不能确定,故B错误;
C.元素的非金属性越强,对应的单质的氧化性越强,X的单质X2能将Y的阴离子Y2-氧化,并发生置换反应,可说明非金属性:X>Y,故C正确;
D.元素的非金属性越强,对应的氢化物越稳定,X的氢化物比Y的氢化物稳定,说明非金属性X比Y强,故D正确.
故选B.
点评 本题考查非金属性的比较,题目难度不大,注意B项为易错点,比较非金属性对应的酸应是最高价含氧酸.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.设NA为阿伏加德罗常数,下列叙述正确的是(相对原子质量O-16 Na-23)( )
| A. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 100 mL 1 mol•L-1的H2SO4溶液中含有0.1NA个H+ | |
| C. | 将4 g NaOH溶于100 g蒸馏水中,所得溶液物质的量浓度是0.1 mol•L-1 | |
| D. | 20g重水(D2O)所含的电子数为10NA |
9.下列说法中不正确的是( )
| A. | 非金属之间形成的化学键一定是共价键 | |
| B. | 在共价化合物中不可能含有离子键 | |
| C. | 只含有共价键的物质一定是共价化合物 | |
| D. | 含有离子键的化合物一定是离子化合物 |
16.下列物质的电子式书写正确的是( )
| A. | Na2O | B. | H2S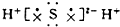 | C. | H2O2 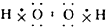 | D. | N2 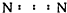 |
6.下列反应不属于消去反应的是( )
| A. | 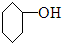 $\stackrel{浓H_{2}SO_{4}△}{→}$ $\stackrel{浓H_{2}SO_{4}△}{→}$ +H2O +H2O | |
| B. | CH3CHBrCH3+NaOH$→_{△}^{醇}$CH3CH=CH2↑+NaBr+H2O | |
| C. | 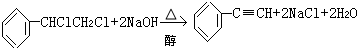 | |
| D. | 2CH3OH$→_{△}^{浓硫酸}$CH3-O-CH3+H2O |
13.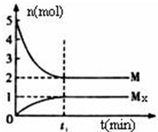 E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
 E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A. | 平衡时混合气体的平均摩尔质量是33.3g/mol | |
| B. | t1时刻,保持温度不变,再充入5molM,重新达到平衡时,c(Mx)/c(M)将减小 | |
| C. | 该反应的化学方程式是2HF?(HF)2 | |
| D. | M的沸点比同主族下一周期元素的气态氢化物沸点低 |
11.下列说法正确的是( )
| A. | 油脂是植物油和动物脂肪的统称,分子的不饱和程度越大,熔点越低 | |
| B. | 氨基酸、二肽、蛋白质均既能跟强酸反应又能跟强碱反应,是两性氧化物 | |
| C. | 石油经裂化得到的汽油可用来萃取溴水中的Br2 | |
| D. | 麻黄碱(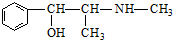 )的催化氧化产物能发生银镜反应 )的催化氧化产物能发生银镜反应 |
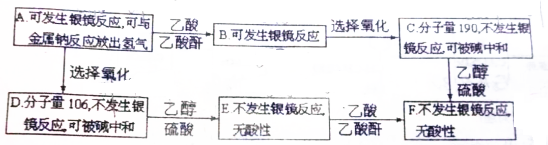
 .
.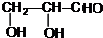 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$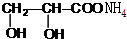 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$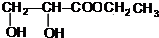 +H2O,属于取代反应(填反应类型).
+H2O,属于取代反应(填反应类型).