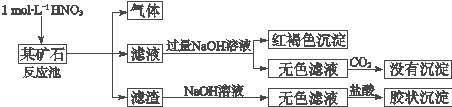
题目内容
19.今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,A和B分别是( )| A. | Si和Na | B. | B和H | C. | Cl和C | D. | C和Al |
分析 根据题意和电子排布规律,确定A、B的电子层数和各层排布的电子数.
解答 解:根据题意,B原子的L层电子数恰为A原子L层电子数的2倍,而L层最多排布8个电子,因此,B的L层有8个电子,而A的L层有4个电子(无M层),根据“A原子的M层比B原子的M层少3个电子”可知,B的M层上有3个电子,即A共有K、L电子层,排布的电子数分别为2、4,B共有K、L、M电子层,排布的电子数分别为2、8、3,故A是C,B是Al,因此D正确.
故选D.
点评 本题要根据题目电子层和电子数的关系,逐步确定A、B的电子层数和各层上的电子数,有些同学思维混乱,原因是没理清题目中的信息,不能结合电子排布规律分析,因此要把排布规律与题意结合起来,整体把握.

练习册系列答案
相关题目
4.有部分元素的性质与原子(或分子)结构如下表:
(1)写出元素T的原子结构示意图: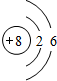 .
.
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示).下列表述中能证明这一事实的是cd(填序号).
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物对应的水化物的碱性比Z强
(3)写出T与Y形成的化合物的化学式Na2O,Na2O2.
(4)元素T和氢元素以原子个数比1:1化合形成化合物Q,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:N2H4+2H2O2═N2↑+4H2O.
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
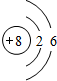 .
.(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示).下列表述中能证明这一事实的是cd(填序号).
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物对应的水化物的碱性比Z强
(3)写出T与Y形成的化合物的化学式Na2O,Na2O2.
(4)元素T和氢元素以原子个数比1:1化合形成化合物Q,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:N2H4+2H2O2═N2↑+4H2O.
11.下列有机物中,既能使溴水褪色,也能使酸性高锰酸钾溶液褪色,还能使蓝色石蕊试纸变红的是( )
| A. | 丙烯酸 | B. | 甲酸乙酯 | C. | 甲苯 | D. | 乙酸 |
8.在室温条件下,如下方法配制溶液,其浓度正确的是( )
| A. | 1mol Na2CO3固体溶于1L水中配成溶液,其物质的量浓度为1mol/L | |
| B. | 40g NaOH固体溶于100g水,配成的溶液质量百分比浓度为40% | |
| C. | 22.4L氨气溶于水配成1L溶液,其物质的量浓度为1mol/L | |
| D. | 1mol NaCl固体溶于水配成1L溶液,其物质的量浓度为1mol/L |
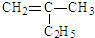
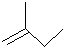
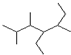 的名称2,3,5-三甲基-4-乙基庚烷
的名称2,3,5-三甲基-4-乙基庚烷 ②氢氧根离子
②氢氧根离子
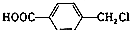 水解制得,写出K在浓硫酸作用下生成的聚合物的结构简式
水解制得,写出K在浓硫酸作用下生成的聚合物的结构简式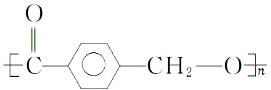 .
.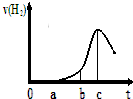 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图. 现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:
现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题: