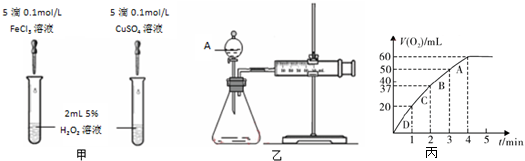
题目内容
9.如图是实验室进行氨气还原氧化铜的实验,并检验反应产物的装置,如图: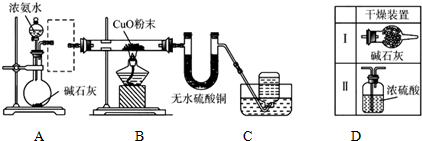
实验现象记录如下:①黑色氧化铜粉末变为光亮红色;②无水硫酸铜粉末变蓝色;③集气瓶中收集到一种无色气体.
请回答下列问题:
(1)装置A中盛放浓氨水的仪器名称是分液漏斗,装置A是制备氨气的发生装置,写出装置中发生的化学反应方程式:CaO+H2O=Ca(OH)2,NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O
(2)虚线框内是否应添加必要的干燥装置是(填”是”或”否”).若需要,应选择的干燥装置是Ⅰ(填编号,若不需要,该空可不填)
(3)根据反应现象写出硬质玻璃管中CuO粉末处发生反应的化学方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O
(4)实验室制取氨气有多种方法,写出使用”固-固加热型”装置制取氨气的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
分析 (1)熟悉仪器的形状,说出其名称;浓氨水滴到生石灰上,生石灰与水反应生成氢氧化钙,放出热量,且氢氧化钙电离产生氢氧根离子,抑制一水合氨的电离,促进氨气的逸出;
(2)制备的氨气中含有水蒸气,进入B容易炸裂试管,应进行干燥;氨气为碱性气体,应选择碱性干燥剂;
(3)氨气还原氧化铜生成铜和氮气和水;
(4)使用”固-固加热型”装置制取氨气,可以选择氯化铵与氢氧化钙为原料,二者在加热条件下生成氨气.
解答 解:(1)图中A中盛放浓氨水的仪器为分液漏斗;浓氨水滴到生石灰上,生石灰与水反应生成氢氧化钙,方程式:CaO+H2O=Ca(OH)2,放出热量,促进氨气的逸出:方程式:NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
故答案为:分液漏斗;CaO+H2O=Ca(OH)2,NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(2)制备的氨气中含有水蒸气,进入B容易炸裂试管,应进行干燥;氨气为碱性气体,应选择碱性干燥剂,碱石灰为碱性干燥剂,可以干燥氨气,浓硫酸与氨气反应,不能用来干燥氨气;
故答案为:是;Ⅰ;
(3)氨气还原氧化铜生成铜和氮气和水,方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
故答案为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
(4)氯化铵与氢氧化钙都是固体,二者在加热条件下反应生成氯化钙、氨气和水,方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
点评 本题考查了氨气的制备和性质的检验,明确实验原理及氨气的性质是解题关键,题目难度不大.

| A. | Si和Na | B. | B和H | C. | Cl和C | D. | C和Al |
| 甲 | 乙 | 丙 | |
| 所含元素 | C、H | C、H、F | C、H、F |
| 所含电子数 | 26 | ||
| 结构特点 | 饱和有机物 | ||
(1)甲的分子式为C3H8,若甲分子中有2个氢原子被F原子取代,所得的有机产物可能有4种.
(2)乙是性能优良的环保产物,可代替某些破坏臭氧层的氟利昂产品用作制冷剂.其分子中C、H、F的原子个数之比为1:2:2,则乙的结构式为
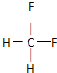 .下列关于乙的叙述正确的是D.
.下列关于乙的叙述正确的是D.A.其分子构型为正四面体形 B.它能使溴水褪色
C.1mol 乙最多能与1mol F2 发生取代反应 D.它没有同分异构体
(3)将甲、乙按物质的量之比1:1混合,所得混合物的平均摩尔质量等于丙的摩尔质量,且丙分子不存在同分异构体,则丙的分子式为C2H5F.
| A. | .丙烷分子的比例模型: | B. | 丙烯的键线式: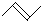 | ||
| C. | .醛基的电子式: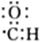 | D. | .甲醚的结构式: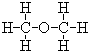 |
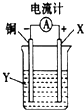
| A. | X可以是银或石墨 | B. | Y是硫酸铜溶液 | ||
| C. | 电子从铜电极经外电路流向X电极 | D. | X极发生还原反应 |