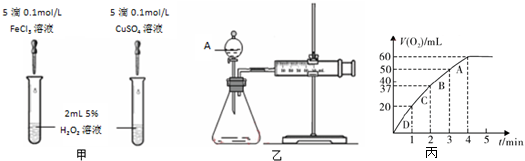
题目内容
14.欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示.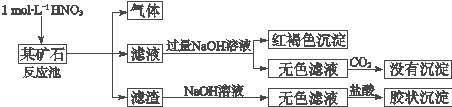
(1)下列说法正确的是ac.
a.酸性:H2CO3>H2SiO3 b.结合质子的能力:CO32->AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4 d.离子半径:O2-<Al3+
(2)该矿石的组成是FeCO3和SiO2,滤渣和NaOH溶液反应的离子方程式是SiO2+2OH-=SiO32-+H2O.
(3)该矿石和1mol?L-1HNO3反应的离子方程式3FeCO3+10H++NO3-=3Fe3++3CO2↑+NO↑+5H2O.
(4)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,用化学方程式解释该方法的目的:NO循环使用能减少环境污染,NO跟H2O、O2反应后又得到硝酸提高原料利用率;若按以上方案:NO与O2循环通入反应池处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1mol.L-1HNO3的体积为3×104L.
分析 (1)a.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
b.对应的酸越强,则酸根离子得到质子的能力越弱;
c.元素的非金属性越强,对应的氢化物越稳定;
d.两种离子核外电子排布相同,核电荷数越大,离子半径越小;
(2)矿石加硝酸生成气体,可说明含有FeCO3,加入过量NaoH溶液后通入过量二氧化碳没有沉淀生成,说明没有Al2O3,滤渣溶解后加入盐酸生成胶状沉淀,说明含有SiO2;
(3)矿石含有FeCO3,可与HNO3反应;
(4)处理该矿石,逸出的气体为NO,可与氧气反应生成硝酸,可循环利用,结合反应的方程式计算.
解答 解:(1)a.非金属性:C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故a正确;
b.酸性:H2CO3>HCO3->Al(OH)3,对应的酸越强,则酸根离子得到质子的能力越弱,则结合质子能力:AlO2->CO32->HCO3-,故b错误;
c.非金属性O>C>Si,元素的非金属性越强,对应的氢化物越稳定,故c正确;
d.两种离子核外电子排布相同,核电荷数越大,离子半径越小,则O2->Al3+,故d错误;
故答案为:ac;
(2)矿石加硝酸生成气体,可说明含有FeCO3,加入过量NaoH溶液后通入过量二氧化碳没有沉淀生成,说明没有Al2O3,滤渣溶解后加入盐酸生成胶状沉淀,说明含有SiO2,滤渣和NaOH溶液反应的离子方程式是SiO2+2OH-=SiO32-+H2O,
故答案为:FeCO3和SiO2;SiO2+2OH-=SiO32-+H2O;
(3)矿石含有FeCO3,可与HNO3反应,离子方程式为3FeCO3+10H++NO3-=3Fe3++3CO2↑+NO↑+5H2O,
故答案为:3FeCO3+10H++NO3-=3Fe3++3CO2↑+NO↑+5H2O;
(4)由于NO是有毒气体,不能随意排放,所以这样做的目的是NO循环使用能减少环境污染,且NO跟H2O、O2反应后又得到硝酸提高原料利用率.根据以上分析可知,该矿石中含有碳酸亚铁和二氧化硅,其中碳酸亚铁的质量是2.36×103 kg-1.2×103 kg=1.16×103kg,物质的量是10000mol,则根据(3)中的方程式可知,消耗硝酸的物质的量是$\frac{1{0}^{5}}{3}$mol,所以理论上至少需要1molL-1 HNO3的体积为3.0×104L.
故答案为:NO循环使用能减少环境污染,NO跟H2O、O2反应后又得到硝酸提高原料利用率;3×104.
点评 本题综合考查粗硅的制备、元素周期律的应用、物质的检验、氧化还原反应方程式的书写、尾气处理和原料的使用以及有关计算,难度较大,注意必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.

| A. |  读取滴定 | B. |  排除滴定 | ||
| C. | 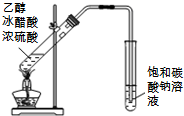 制取并收集 | D. | 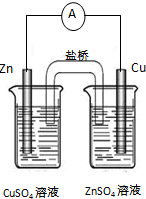 构成铜锌 |
| A. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | KNO3晶体(NaCl),蒸馏水,结晶 | |
| D. | C2H5OH(水),加足量CaO,蒸馏 |
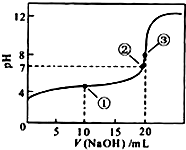 常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(Na+)>c(OH-) |
| A. | Si和Na | B. | B和H | C. | Cl和C | D. | C和Al |
 1L某混合溶液,可能含有的离子如下表:
1L某混合溶液,可能含有的离子如下表:| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
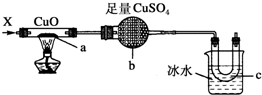
| A. | H2 | B. | CO和H2 | C. | NH3 | D. | CH3CH2OH(气) |
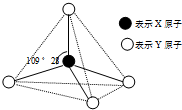 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.请回答下列问题:
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.请回答下列问题: