题目内容
19.锰酸锂(LiaMnbOc)是动力锂离子电池的一种正极材料,其中的锰元素显+4、+3及+2价三种价态.实验室可通过连续滴定法测定其中锰元素的平均价态(平均价态=$\frac{化合物中同种元素不同价态的代数和}{该元素原子数目总和}$,如Fe3O4中铁元素平均价态为+$\frac{8}{3}$),实验步骤如下:
已知相关部分反应如下:
①2Mn3++C2O42-=2Mn2++2CO2↑;2Mn4++C2O42-=2Mn2++2CO2↑
②2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
③14Mn2++2ClO4-+28PO43-+16H+=14Mn(PO4)23-+Cl2↑+8H2O
(1)LiaMnbOc中锂显+1价,氧显-2价,则锰元素的平均价态为+$\frac{2c-a}{b}$(用含a、b、c代数式表示).
(2)判断步骤②滴定达到终定时的判断依据是当滴入最后一定高锰酸钾溶液,溶液由无色变为浅红色,且30s内不褪色.步骤②滴定速度不能过快.否则在酸性的热溶液中高锰酸钾会转化为二氧化锰及氧气,该反应的离子方程式为4MnO4-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$4MnO2+2H2O+3O2↑.
(3)已知V1=22.00,V2=16.40,根据以上实验数据计算该锰酸锂试样中锰的平均价态(写出计算过程,结果保留2位小数).
分析 (1)LiaMnbOc中锂显+1价,氧显-2价,设Mn的化合价为+x,根据化合价代数和为零求锰的化合价
(2)用高锰酸钾溶液滴定剩余的草酸钠,当滴定完全后,显示高锰酸钾的颜色,当滴入最后一定高锰酸钾溶液,溶液由无色变为浅红色,且30s内不褪色;高锰酸钾在酸性条件下,发生自身氧化还原反应,生成二氧化锰及氧气;
(3)n(Na2C2O4)=0.2000mol/L×0.01L=2.000×10-3mol,
n(KMnO4)=0.02000mol/L×0.022L=4.400×10-4mol,
还原Mn4+、Mn3+的草酸钠为2.000×10-3mol-$\frac{5}{2}$×4.400×10-4mol=9.000×10-4mol,
n(Mn4+)+$\frac{1}{2}$n(Mn3+)=9.000×10-4mol ①
锰酸锂(LiaMnbOc)中总锰量为n(Mn4+)+n(Mn3+)+n(Mn2+)=n[(NH4)2Fe(SO4)2]-n(KMnO4)=0.1000mol/L×0.0164L-4.400×10-4mol=1.2000×10-3mol②,最后锰根据锰的总化合价除以锰的总物质的量为平均价态.
解答 解:(1)LiaMnbOc中锂显+1价,氧显-2价,设Mn的化合价为+x,根据化合价代数和为零,a+bx-2c=0,x=+$\frac{2c-a}{b}$;
故答案为:+$\frac{2c-a}{b}$;
(2)用高锰酸钾溶液滴定剩余的草酸钠,当滴定完全后,显示高锰酸钾的颜色,当滴入最后一定高锰酸钾溶液,溶液由无色变为浅红色,且30s内不褪色;高锰酸钾在酸性条件下,发生自身氧化还原反应,生成二氧化锰及氧气,离子方程式为4MnO4-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$4MnO2+2H2O+3O2↑;
故答案为:当滴入最后一定高锰酸钾溶液,溶液由无色变为浅红色,且30s内不褪色;4MnO4-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$4MnO2+2H2O+3O2↑;
(3)n(Na2C2O4)=0.2000mol/L×0.01L=2.000×10-3mol,
n(KMnO4)=0.02000mol/L×0.022L=4.400×10-4mol,
还原Mn4+、Mn3+的草酸钠为2.000×10-3mol-$\frac{5}{2}$×4.400×10-4mol=9.000×10-4mol,
n(Mn4+)+$\frac{1}{2}$n(Mn3+)=9.000×10-4mol ①
锰酸锂(LiaMnbOc)中总锰量为n(Mn4+)+n(Mn3+)+n(Mn2+)=n[(NH4)2Fe(SO4)2]-n(KMnO4)=0.1000mol/L×0.0164L-4.400×10-4mol=1.2000×10-3mol ②,锰酸锂样品中锰的平均价态为$\frac{4n(M{n}^{4+})+3n(M{n}^{3+})+2n(M{n}^{2+})}{n(M{n}^{4+})+n(M{n}^{3+})+n(M{n}^{2+})}$=$\frac{2(①+②)}{②}$=$\frac{4.2000×1{0}^{-3}mol}{1.2000×1{0}^{-3}mol}$=+3.50,
故答案为:+3.50.
点评 本题考查连续滴定法测定锰酸锂(LiaMnbOc)中锰元素的平均价态,难度较大,注意锰的总化合价除以锰的总物质的量为平均价态.

①HClO的氧化性比H2SO4的氧化性强;
②常温下氯气是气态而硫是固态;
③盐酸酸性比氢硫酸强;
④HCl比H2S稳定;
⑤H2S能被Cl2氧化成硫;
⑥HClO4酸性比H2SO4强;
⑦氯气与氢气化合比硫与氢气化合要容易进行;
⑧Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
| A. | ①②③④⑤⑥⑦⑧ | B. | ①④⑤⑥⑦ | C. | ④⑤⑥⑦⑧ | D. | ③④⑤⑦⑧ |
| A. | 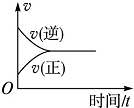 | B. | 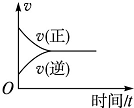 | C. | 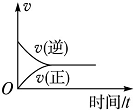 | D. | 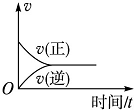 |
| A. | CH3COOH=CH3COO-+H+ | B. | NaOH=Na++OH- | ||
| C. | NH4Cl?NH4++Cl- | D. | NaHCO3=Na++H++CO32-. |
| A. | 用药匙取用粉末状或颗粒状固体 | B. | 用胶头滴管滴加少量液体 | ||
| C. | 倾倒液体时试剂瓶标签面向手心 | D. | 给盛有$\frac{2}{3}$体积液体的试管加热 |
 ;
;