题目内容
13.下列各组离子在指定环境中一定能大量共存的是( )| A. | 使pH试纸显深蓝色的溶液中,Cu2+、NO3-、Fe3+、SO42- | |
| B. | 在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ | |
| C. | pH=0的溶液中:Al3+、NH4+、Ca2+、ClO- | |
| D. | 与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42- |
分析 A.使pH试纸显深蓝色的溶液呈碱性,生成沉淀;
B.使红色石蕊试纸变蓝的溶液呈碱性;
C.ClO-酸性条件下不存在;
D.与铝粉反应放出氢气的无色溶液可能呈强碱性,也可能为非氧化性酸溶液.
解答 解:A.使pH试纸显深蓝色的溶液呈碱性,Cu2+、Fe3+在碱性条件下不能大量共存,生成沉淀,故A错误;
B.使红色石蕊试纸变蓝的溶液呈碱性,碱性条件下离子之间不发生任何反应,可大量共存,故B正确;
C.ClO-酸性条件下不存在,且与Al3+发生互促水解反应,故C错误;
D.与铝粉反应放出氢气的无色溶液可能呈强碱性,也可能为非氧化性酸溶液,酸性条件下不能存在NO3-,否则不生成氢气,碱性条件下Mg2+不能大量共存,故D错误.
故选B.
点评 本题考查离子共存,为高频考点,侧重于学生的分析能力的考查,注意把握常见离子的性质以及反应类型的判断,答题时注意溶液的性质,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列叙述中错误的是( )
| A. | 离子半径:S2->Cl->O2- | B. | 还原性:Na>Mg>Al | ||
| C. | 沸点:HF>HCl>HBr | D. | 酸性:HClO4>H2SO4>H3PO4 |
7.组成结构可用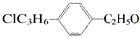 表示的有机物中,能发生消去反应的共有( )
表示的有机物中,能发生消去反应的共有( )
 表示的有机物中,能发生消去反应的共有( )
表示的有机物中,能发生消去反应的共有( )| A. | 25种 | B. | 20种 | C. | 16种 | D. | 14种 |
18.下列家庭小实验不能制得溶液的是( )
| A. | 食盐+水 | B. | 泥土+水 | C. | 植物油+汽油 | D. | 蔗糖+水 |
5.普通干电池两极材料是锌和石墨棒,两极间为MnO2、NH4Cl、ZnCl2糊状物,下列说法错误的是( )
| A. | 干电池中锌作负极,石墨棒作正极 | |
| B. | 负极发生还原反应:Zn-2e-═Zn2+ | |
| C. | MnO2的作用是把正极附近生成的氢气氧化成水,避免氢气泡出现 | |
| D. | 干电池工作时,由化学能转变为电能 |
2.已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表,下列叙述正确的是( )
| 酸 | 电离平衡常数 |
| 醋酸 | Ki=1.75×10-5 |
| 次氯酸 | Ki=2.98×10-8 |
| 碳酸 | Ki1=4.30×10-7Ki2=5.61×10-11 |
| 亚硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
| A. | 将0.1 mol•L-1的醋酸加水不断稀释,c(OH-)始终减小 | |
| B. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| D. | 25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 |
3.N2中混有少量CO2气体和水蒸气,除去的正确操作是( )
| A. | 通过无水氯化钙的干燥管 | |
| B. | 通过浓硫酸的洗气瓶 | |
| C. | 先通过氢氧化钠溶液的洗气瓶,再通过浓硫酸的洗气瓶 | |
| D. | 先通过浓硫酸的洗气瓶,再通过氢氧化钠溶液的洗气瓶 |