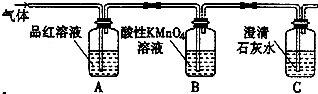
题目内容
15.硅及其化合物的用途非常广泛.回答下列问题:(1)硅在元素周期表中的位置为第三周期,第ⅣA族,二氧化硅属于酸性(填“酸性”、“碱性”或“两性”)氧化物.
(2)锌还原SiCl4是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:

①焦炭在过程Ⅰ中的作用是还原剂;SiCl4遇水剧烈水解生成SiO2和一种酸,反应的化学方程式是SiCl4+2H2O═SiO2+4HCl.
②若上述制备过程中粗Si和SiCl4均损失20%,且制粗硅时有10%的SiO2转化为SiC,则100t含SiO2 70%的石英砂在生产高纯硅过程中消耗锌的质量为109.2t(保留两位小数).
分析 (1)硅是14号元素在周期表中处于第三周期,第ⅣA族元素,二氧化硅与碱反应生成盐与水,所以是酸性氧化物;
(2)①依据碳与二氧化硅反应中元素化合价变化判断;根据SiCl4遇水剧烈水解生成SiO2和一种酸信息,反应物是SiCl4和水,生成物为二氧化硅,根据氧原子守恒,水分子前的系数为2,根据氢原子和氯原子守恒,另一产物为氯化氢;
②根据石英砂和硅之间关系式计算.
解答 解:(1)硅是14号元素在周期表中处于第三周期,第ⅣA族元素,二氧化硅与碱反应生成盐与水,所以是酸性氧化物,故答案为:第三周期,第ⅣA族;酸性;
(2)①碳与二氧化硅反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,碳元素在反应中化合价升高,发生氧化反应,碳做还原剂;根据SiCl4遇水剧烈水解生成SiO2和一种酸信息,反应物是SiCl4和水,生成物为二氧化硅,根据氧原子守恒,水分子前的系数为2,根据氢原子和氯原子守恒,另一产物为氯化氢,氯化氢前的系数为4,据此即可写出化学反应方程式SiCl4+2H2O═SiO2+4HCl,故答案为:还原剂;SiCl4+2H2O═SiO2+4HCl;
②由反应原理可知,则:
SiO 2~Si~SiCl 4~Si(纯)~2Zn
60 2×65
100t×70%×(1-10%)×80% m
所以:$\frac{60}{100t×70%×(1-10%)×80%}$=$\frac{2×65}{m}$,解得m=109.2,故答案为:109.2.
点评 本题考查了硅及其化合物的性质、化学反应方程式的书写及相关计算,掌握硅及其化合物的性质是解答的关键,难度中等.

 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.(1)Y原子核外共有7种不同运动状态的电子,T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).由X、Y、Z形成的离子ZXY?与XZ2互为等电子体,则ZXY?中X原子的杂化轨道类型为sp杂化
(3)Z与R能形成化合物甲,1mol甲中含4mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为正四面体形
(4)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
(6)X单质的晶胞如右图所示,一个X晶胞中有8个X原子;若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为$\frac{3}{4}\root{3}{\frac{12}{P{N}_{A}}}$cm(用代数式表示)
| A. | 离子半径:S2->Cl->O2- | B. | 还原性:Na>Mg>Al | ||
| C. | 沸点:HF>HCl>HBr | D. | 酸性:HClO4>H2SO4>H3PO4 |
| A. | CuSO4 | B. | HC1 | C. | NaCl | D. | NaOH |
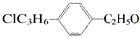 表示的有机物中,能发生消去反应的共有( )
表示的有机物中,能发生消去反应的共有( )| A. | 25种 | B. | 20种 | C. | 16种 | D. | 14种 |
| 酸 | 电离平衡常数 |
| 醋酸 | Ki=1.75×10-5 |
| 次氯酸 | Ki=2.98×10-8 |
| 碳酸 | Ki1=4.30×10-7Ki2=5.61×10-11 |
| 亚硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
| A. | 将0.1 mol•L-1的醋酸加水不断稀释,c(OH-)始终减小 | |
| B. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| D. | 25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 |