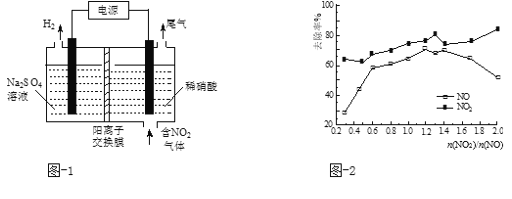
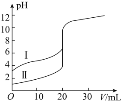
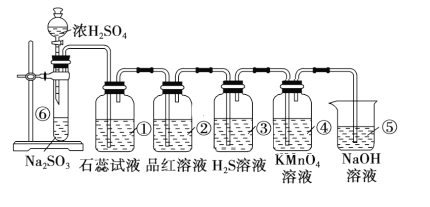
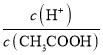题目内容
【题目】我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
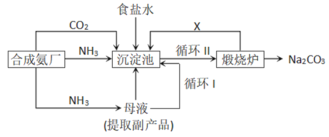
(1)实验室制取氨气的反应方程式为______
(2)上述生产纯碱过程副产品是______。
(3)沉淀池中发生的化学反应方程式是______。
(4)写出上述流程中X物质的电子式______。
(5)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了______(选填循环Ⅰ或循环Ⅱ)的循环。从沉淀池中取出沉淀的操作是_________。
(6)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加________。
【答案】Ca(OH)2+2NH4Cl![]() 2NH3↑+CaCl2+2H2O 氯化铵(NH4Cl) NH3 + CO2 + H2O + NaCl → NH4Cl + NaHCO3↓
2NH3↑+CaCl2+2H2O 氯化铵(NH4Cl) NH3 + CO2 + H2O + NaCl → NH4Cl + NaHCO3↓ ![]() 循环Ⅰ 过滤 稀硝酸和硝酸银溶液
循环Ⅰ 过滤 稀硝酸和硝酸银溶液
【解析】
解答本题关键是清楚侯德榜制碱法的流程和反应原理,清楚每一步的操作和产物便可解答,反应原理首先是氨气、二氧化碳和水反应生成碳酸氢氨,然后碳酸氢氨和氯化钠发生复分解反应交换成分生成碳酸氢钠晶体和氯化铵,煅烧炉中发生的反应是碳酸氢钠受热分解,生成纯碱、二氧化碳气体和水,所以X是二氧化碳,循环Ⅱ为二氧化碳循环,因为氯化钠最后剩余在母液中,所以循环I是氯化钠的循环,据此分析解答。
(1)实验室用氢氧化钙和氯化铵在加热的条件下制取氨气,反应方程式为Ca(OH)2+2NH4Cl![]() 2NH3↑+CaCl2+2H2O;
2NH3↑+CaCl2+2H2O;
(2)目前工业制碱方法有二:氨碱法和联合制碱法,题中方法是由侯德榜所创,称为侯氏制碱法,也称为联合制碱法,反应方程式为NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓,故副产物为氯化铵(NH4Cl);
(3)根据图示和(2)中分析,沉淀池中发生的化学反应方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓;
(4)在联合制碱法中X是煅烧碳酸氢钠制得的产物,可以循环利用,所以该产物为二氧化碳,X物质的电子式![]() ;
;
(5)循环Ⅰ是将未反应的氯化钠返回沉淀池中,从固液混合物中分离出固体的方法为过滤;
(6)检验产品碳酸钠中是否含有氯化钠即检验是否含氯离子,可取少量试样溶于水后,再滴加硝酸酸化的硝酸银,观察若产生白色沉淀则说明有氯化钠存在。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案