题目内容
【题目】如图是实验室制取SO2并验证SO2某些性质的装置图。已知SO2具有:A.酸性、B.氧化性、C.还原性、D.漂白性。
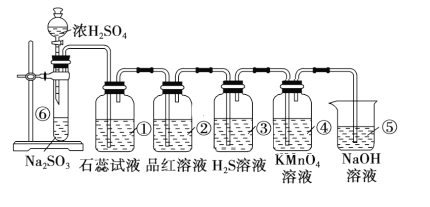
试回答:
(1)①中的现象为__,证明SO2具有__性(请填字母);
(2)②中的品红溶液__,证明SO2有__性(请填字母);
(3)④中的现象是__,证明SO2有__性(请填字母);
(4)⑤的作用是___,试写出该反应的离子反应方程式__。
【答案】石蕊试液变红 A 褪色 D 高锰酸钾溶液褪色 C 吸收多余的SO2,防止污染环境 SO2+2OH-=SO32-+H2O
【解析】
SO2性质的探究,使石蕊试液变红,体现它的酸性;使品红溶液褪色体现它的漂白性;使高锰酸钾溶液褪色体现它的还原性;氢氧化钠溶液吸收多余的SO2,防止污染空气。
(1)SO2气体通过石蕊试液,SO2和水反应生成亚硫酸,具有酸性,使石蕊试液变红,证明SO2具有酸性,故选A;
(2)SO2气体通过品红溶液,品红溶液褪色,证明SO2有还原性,故选D;
(3)SO2气体通过高锰酸钾溶液,SO2将MnO4-中+7价的锰元素还原为Mn2+,SO2被氧化为SO42-,溶液褪色,体现SO2的还原性,故选C;
(4)SO2有毒,排放到空气中会污染环境,用氢氧化钠溶液吸收多余的SO2,该离子方程式为SO2+2OH-=SO32-+H2O。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目