题目内容
【题目】有效去除大气中的NOx和SO2是环境保护的重要课题。
(1)酸性条件下,NaClO2吸收NO的相关热化学方程式如下:
4NO(g) + 3NaClO2(aq) + 2H2O(l) = 4HNO3(aq) + 3NaCl(aq) ΔH= a kJ·mol1
5NaClO2(aq) + 4HCl(aq) = 4ClO2(g) + 2H2O(l) + 5NaCl(aq) ΔH= b kJ·mol1
反应5NO(g) + 3ClO2(g) + 4H2O(l) = 5HNO3(aq) + 3HCl(aq) ΔH=________kJ·mol1。
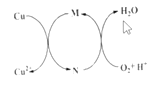
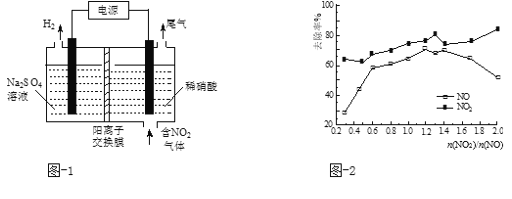
(2)用电解法处理氮氧化物可回收硝酸。实验室模拟电解NO2的装置如图-1所示。写出电解时阳极的电极反应式:________。
(3)用CO(NH2)2水溶液吸收SO2并通入O2,反应生成(NH4)2SO4和CO2。写出该反应的化学方程式:___________。
(4)利用活性焦炭的吸附作用,可以对烟气进行脱硫和脱硝。被吸附的NO2与活性焦炭反应生成N2和CO2,当生成1 mol N2时,转移的电子数为_________mol。
(5)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入0.05 mol·L1的Ca(OH)2乳浊液中,发生的反应为:3NO2 + 2OH-= NO +2NO3-+ H2O;NO + NO2 +2OH-= 2NO2- + H2O。改变![]() ,NOx的去除率见图-2。
,NOx的去除率见图-2。
①![]() 的合适范围是___________________。
的合适范围是___________________。
②当![]() 大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是______ 。
大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是______ 。
③O3和NO发生的主要反应为:NO + O3 = NO2 + O2。保持NO的初始浓度不变,改变![]() ,将反应后的混合气体通入0.05mol·L1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则
,将反应后的混合气体通入0.05mol·L1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则![]() 合适的值约为_________。
合适的值约为_________。
a.0.6 b.0.8 c.1.4
【答案】5a-3b/4 NO2 e + H2O = 2H+ + NO3 2CO(NH2)2 + 2SO2 + 4H2O + O2 = 2 (NH4)2SO4+ 2CO2 8 1.2-1.4 NO2和OH-反应生成NO3-和NO,导致NO去除率降低 a
【解析】
(1)酸性条件下,NaClO2吸收NO的相关热化学方程式如下:
①4NO(g) + 3NaClO2(aq) + 2H2O(l) = 4HNO3(aq) + 3NaCl(aq)△H=a kJmol-1
②5NaClO2(aq) + 4HCl(aq) = 4ClO2(g) + 2H2O(l) + 5NaCl(aq)△H=b kJmol-1
盖斯定律计算(①×5-②×3)×![]() 得到反应5NO(g) + 3ClO2(g) + 4H2O(l) = 5HNO3(aq) + 3HCl(aq);
得到反应5NO(g) + 3ClO2(g) + 4H2O(l) = 5HNO3(aq) + 3HCl(aq);
(2)根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子和水生成硝酸;
(3)用CO(NH2)2水溶液吸收SO2并通入O2,反应生成(NH4)2SO4和CO2,结合原子守恒和电子守恒平配平书写化学方程式;
(4)被吸附的NO2与活性焦炭反应生成N2和CO2,写出化学方程式,结合方程式中的定量关系计算电子转移总数;
(5)①图象读取去除率最高时的![]() 的合适范围;
的合适范围;
②当![]() 大于1.4时,NO2去除效率升高,但NO去除效率却降低是因为二氧化氮反应生成一氧化氮;
大于1.4时,NO2去除效率升高,但NO去除效率却降低是因为二氧化氮反应生成一氧化氮;
③O3和NO发生的主要反应为:NO+O3=NO2+O2.保持NO的初始浓度不变,改变![]() ,节省O3的用量,又能保持NOx去除效果,需要保持
,节省O3的用量,又能保持NOx去除效果,需要保持![]() 的合适范围是1.2~1.4。
的合适范围是1.2~1.4。
(1)酸性条件下,NaClO2吸收NO的相关热化学方程式如下:
①4NO(g)+3NaClO2(aq)+2H2O(l)=4HNO3(aq)+3NaCl(aq)△H=akJmol1
②5NaClO2(aq)+4HCl(aq)=4ClO2(g)+2H2O(l)+5NaCl(aq)△H=bkJmol1
盖斯定律计算(①×5②×3)×![]() 得到反应5NO(g)+3ClO2(g)+4H2O(l)=5HNO3(aq)+3HCl(aq)△H=
得到反应5NO(g)+3ClO2(g)+4H2O(l)=5HNO3(aq)+3HCl(aq)△H=![]() kJ/mol,
kJ/mol,
故答案为:![]() ;
;
(2)根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子和水生成硝酸,电极反应式为NO2e+H2O=NO3+2H+,
故答案为:NO2e+H2O=NO3+2H+;
(3)用CO(NH2)2水溶液吸收SO2并通入O2,反应生成(NH4)2SO4和CO2,反应的化学方程式:2CO(NH2)2+2SO2+4H2O+O2=2(NH4)2SO4+2CO2,
故答案为:2CO(NH2)2+2SO2+4H2O+O2=2(NH4)2SO4+2CO2;
(4)被吸附的NO2与活性焦炭反应生成
故答案为:8;
(5)①图中曲线变化分析可知,![]() 的合适范围是1.21.4,在此范围去除率最大,
的合适范围是1.21.4,在此范围去除率最大,
故答案为:1.21.4;
②当![]() 大于1.4时,NO2去除效率升高,但NO去除效率却降低,原因是:NO2和OH反应生成NO3和NO,导致NO去除率降低,
大于1.4时,NO2去除效率升高,但NO去除效率却降低,原因是:NO2和OH反应生成NO3和NO,导致NO去除率降低,
故答案为:NO2和OH反应生成NO3和NO,导致NO去除率降低;
③O3和NO发生的主要反应为:NO+O3=NO2+O2,保持NO的初始浓度不变,改变![]() ,节省O3的用量,又能保持NOx去除效果,需要保持
,节省O3的用量,又能保持NOx去除效果,需要保持![]() 的合适范围是1.21.4,则
的合适范围是1.21.4,则![]() 合适的值约为0.60.7,故选a,
合适的值约为0.60.7,故选a,
故答案为:a。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】锰锌铁氧体是应用广泛的高性能磁性材料。现以akg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%)制备锰锌铁氧体,主要流程如下:
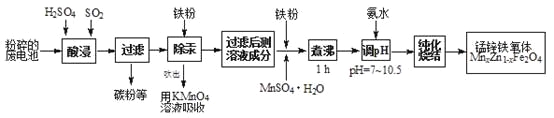
(1)酸浸废电池时,被溶解生成Zn2+的物质有______,SO2的作用是_____(填字母编号)。
A.漂白剂 | B.沉淀剂 | C.氧化剂 | D.还原剂 |
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围反应的主要产物。
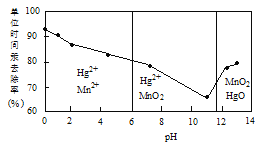
①pH<6时反应的离子方程式为___________。
②汞的去除速率随pH变化的规律是_________。
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)=2MnO2(s) H=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是_______________。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为____________。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O)_________kg。(只列出计算式)