题目内容
13.新制氯水中存在的微粒是( )| A. | Cl2、HClO、HCl、H2O | |
| B. | Cl、Cl-、Cl2、H2O | |
| C. | Cl2、HCl、H2O、Cl-、H+、ClO-和极少量OH- | |
| D. | Cl2、HClO、H2O、Cl-、H+、ClO-和极少量OH- |
分析 氯水中溶解氯气为黄绿色,氯气与水发生:Cl2+H2O?HClO+HCl,溶液中含有Cl2、HClO、H2O等分子,含有H+、ClO-、Cl-等离子,以此解答.
解答 解:新制氯水溶解氯气为黄绿色,氯气与水发生:Cl2+H2O?HClO+HCl,HClO为弱电解质,存在部分电离,则溶液中含有Cl2、HClO、H2O等分子,含有H+、ClO-、Cl-等离子及极少量OH-,
故选D.
点评 本题考查氯气的性质,侧重于氯水的成分与性质的考查,为高考高频考点,很好地考查学生的科学素养,能提高学生学习的积极性,题目难度不大,注意相关基础知识的积累,本题中要注意氯水的成分和性质.

练习册系列答案
相关题目
4.下列表示对应化学反应的离子方程式正确的是( )
| A. | 次氯酸钠溶液中加入双氧水有氧气放出:ClO-+H2O2═O2↑+Cl-+H2O | |
| B. | 碳酸钙溶于稀醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 用稀硝酸洗涤做过银镜反应的试管:Ag+4H++NO3-═Ag++NO↑+2H2O | |
| D. | 苯酚钠溶液中通入少量CO2: |
1.按照有关方法进行实验,实验结果偏大的是( )
| A. | 测定硫酸铜晶体中结晶水的含量,失水后的硫酸铜晶体置于空气中冷却后再称量质量 | |
| B. | 测定中和热实验中,所使用的氢氧化钠稀溶液的物质的量浓度稍大于盐酸 | |
| C. | 配制一定的物质的量浓度溶液的实验中,容量瓶内壁附有蒸馏水 | |
| D. | 用标准盐酸滴定未知浓度的氢氧化钠溶液,开始俯视读数,终点仰视读数 |
8.用0.01mol/L硫酸滴定0.01mol/L烧碱溶液,中和后加水至100mL.若滴定至终点时判断有误,甲多加了一滴硫酸,而乙则少加了一滴硫酸(20滴为1mL),则甲和乙最终c(H+)的比值为( )
| A. | 10 | B. | 50 | C. | 5×103 | D. | 1×104 |
2.某学习小组探究金属与不同酸反应的差异,以及影响反应速率的因素.
实验药品:2.0moL/L盐酸、4.0mol/L盐酸、2.0mol/L硫酸、4.0mol/L硫酸,相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0mL,金属用量均为9.0g.
(1)帮助该组同学完成以上实验设计表.
(2)该小组同学在对比①和⑤实验时发现①的反应速度都明显比⑤快,你能对问题原因作出哪些假设或猜想(列出一种即可)?Cl-能够促进Al与H+的反应或SO42-对Al与H+的反应起阻碍作用.
实验药品:2.0moL/L盐酸、4.0mol/L盐酸、2.0mol/L硫酸、4.0mol/L硫酸,相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0mL,金属用量均为9.0g.
(1)帮助该组同学完成以上实验设计表.
| 实验目的 | 实验编号 | 温度 | 金属铝的形态 | 酸及浓度 |
| 1.实验①和②探究盐酸浓度对该反应速率的影响 2.实验②和③探究探究温度对反应速率的影响 3.实验②和④探究金属规格(铝片,铝粉)对该反应速率的影响 4.①和⑤实验探究铝与稀盐酸和稀硫酸反应的差异 | ① | 25℃ | 铝片 | 4.0moL/L盐酸 |
| ② | 25℃ | 铝片 | 2.0moL/L盐酸 | |
| ③ | 35℃ | 铝片 | 2.0moL/L盐酸 | |
| ④ | 25℃ | 铝粉 | 2.0moL/L盐酸 | |
| ⑤ | 25℃ | 铝片 | 2.0moL/L硫酸 |
16.某烃的一种同分异构体的一氯代物只有一种,该烃的分子式是( )
| A. | C6H14 | B. | C5H12 | C. | C4H10 | D. | C3H8 |
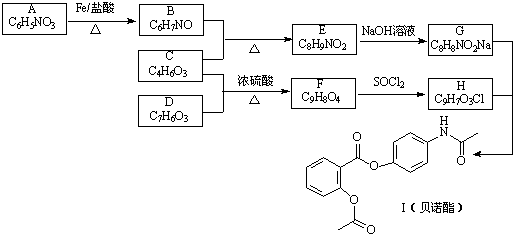
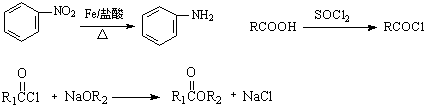
 ,G
,G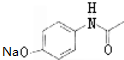 .
. .
. .
. 的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)
的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)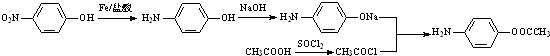 .
.