题目内容
1.按照有关方法进行实验,实验结果偏大的是( )| A. | 测定硫酸铜晶体中结晶水的含量,失水后的硫酸铜晶体置于空气中冷却后再称量质量 | |
| B. | 测定中和热实验中,所使用的氢氧化钠稀溶液的物质的量浓度稍大于盐酸 | |
| C. | 配制一定的物质的量浓度溶液的实验中,容量瓶内壁附有蒸馏水 | |
| D. | 用标准盐酸滴定未知浓度的氢氧化钠溶液,开始俯视读数,终点仰视读数 |
分析 A.测定硫酸铜晶体中结晶水的含量,失水后的硫酸铜晶体置于空气中冷却,无水硫酸铜易吸水;
B.中和热的均是强酸和强碱反应生成1mol水时放出的热,应该用稀的酸碱溶液,但与酸碱的物质的量浓度相对大小无关;
C.配制一定的物质的量浓度溶液的实验中,容量瓶内壁附有蒸馏水不影响配制结果;
D.用标准盐酸滴定未知浓度的氢氧化钠溶液,开始俯视读数,终点仰视读数,会导致溶液体积偏大.
解答 解:A.测定硫酸铜晶体中结晶水的含量,失水后的硫酸铜晶体置于空气中冷却,无水硫酸铜易吸水,会导致水的质量偏小,则实验结果偏小,故A错误;
B.中和热的均是强酸和强碱反应生成1mol水时放出的热,应该用稀的酸碱溶液,但与酸碱的物质的量浓度相对大小无关,为了使酸完全反应,碱的物质的量应该稍微大些,故B错误;
C.配制一定的物质的量浓度溶液的实验中,容量瓶内壁附有蒸馏水,溶质的物质的量、溶液体积都不受影响,则不影响配制结果,故C错误;
D.用标准盐酸滴定未知浓度的氢氧化钠溶液,开始俯视读数,终点仰视读数,会导致溶液体积偏大,则导致测定结果偏大,故D正确;
故选D.
点评 本题考查实验方案评价,为高频考点,侧重考查基本操作,明确实验原理是解本题关键,易错选项是CD,注意容量瓶、滴定管俯视、仰视时对实验结构的影响区别,题目难度中等.

练习册系列答案
相关题目
12.下列离子方程式正确的是( )
| A. | 向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O-→2C6H5OH+CO32- | |
| C. | 向硫酸氢钠溶液中滴入氢氧化钡溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
9.某原电池的电池反应为:Fe+2Fe3+═3Fe2+,与此电池反应不符的原电池是( )
| A. | 铜片、铁片、FeCl3溶液组成的原电池 | |
| B. | 石墨、铁片、Fe(NO3)3溶液组成的原电池 | |
| C. | 银片、铁片、Fe(NO3)2溶液组成的原电池 | |
| D. | 铁片、铜片、Fe2(SO4)3溶液组成的原电池 |
13.新制氯水中存在的微粒是( )
| A. | Cl2、HClO、HCl、H2O | |
| B. | Cl、Cl-、Cl2、H2O | |
| C. | Cl2、HCl、H2O、Cl-、H+、ClO-和极少量OH- | |
| D. | Cl2、HClO、H2O、Cl-、H+、ClO-和极少量OH- |
10.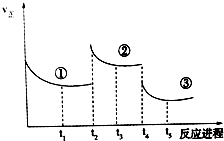 已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如图所示,下列说法正确的是 ( )
已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如图所示,下列说法正确的是 ( )
注:t1~t2、t3~t4、t5之后各时间段表示达到平衡状态①、②、③
 已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如图所示,下列说法正确的是 ( )
已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如图所示,下列说法正确的是 ( )注:t1~t2、t3~t4、t5之后各时间段表示达到平衡状态①、②、③
| A. | t2~t3时间段,平衡向逆反应方向移动 | |
| B. | t4时刻改变的条件是减小压强 | |
| C. | 平衡状态①和②,SO2转化率相同 | |
| D. | 平衡状态①和②,平衡常数K值相同 |
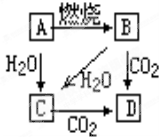 如图中,A是单质,B为淡黄色固体.写出下列转化的化学方程式:
如图中,A是单质,B为淡黄色固体.写出下列转化的化学方程式: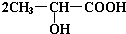 +Na2CO3→
+Na2CO3→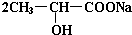 +H2O+CO2↑.
+H2O+CO2↑. .
.