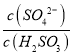题目内容
【题目】以下是处于研究阶段的“人工固氮”的新方法.N2在催化剂表面与水发生反应:
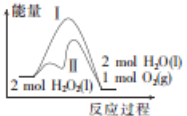
2N2(g)+6H2O(l)4NH3(g)+3O2(g) △H="+" 1530.4kJ/mol;完成下列填空:
(1)该反应平衡常数K的表达式_______.
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡,则______.
a.平衡常数K增大
b.H2O的浓度减小
c.容器内的压强增大
d.v逆(O2)减小
(3)研究小组分别在四个容积为2升的密闭容器中,充入N21mol、H2O 3mol,在催化剂条件下进行反应3小时.实验数据见下表:
序号 | 第一组 | 第二组 | 第三组 | 第四组 |
t/℃ | 30 | 40 | 50 | 80 |
NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
第四组实验中以NH3表示反应的速率是_____,与前三组相比,NH3生成量最小的原因可能是______.
(4)氨水是实验室常用的弱碱.
①往CaCl2溶液中通入CO2至饱和,无明显现象.再通入一定量的NH3后产生白色沉淀,此时溶液中一定有的溶质是_____.请用电离平衡理论解释上述实验现象________________________.
②向盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是______.
a.c(C1﹣)=c(NH4+)>c(H+)=c(OH﹣)
b.c(C1﹣)>c(NH4+)=c(OH﹣)>c(H+)
c.c(NH4+)>c(OH﹣)>c(C1﹣)>c(H+)
d.c(OH﹣)>c(NH4+)>c(H+)>c(C1﹣)
【答案】K=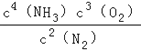 ac 3.33×10﹣7mol/(Lh) 催化剂在80℃活性减小,反应速率反而减慢 NH4Cl 饱和H2CO3溶液中电离产生的CO32﹣很少,因此没有沉淀,加入氨水后,促进H2CO3的电离,CO32﹣离子浓度增大,有沉淀产生 ac
ac 3.33×10﹣7mol/(Lh) 催化剂在80℃活性减小,反应速率反而减慢 NH4Cl 饱和H2CO3溶液中电离产生的CO32﹣很少,因此没有沉淀,加入氨水后,促进H2CO3的电离,CO32﹣离子浓度增大,有沉淀产生 ac
【解析】
(1)根据平衡常数定义得出:化学平衡常数K的表达式K=[c4(NH3)×c3(O2)]/c2(N2);
(2)a、平衡常数只受温度的影响,正反应方向是吸热反应,升高温度,平衡右移,平衡常数增大,正确;b、此时水的状态是液态,浓度是常数,不会改变,错误;c、升高温度,平衡右移,气体系数之和增大,即气体总物质的量增大,压强增大,正确;d、升高温度,无论正反应方向还是逆反应方向的速率增大,错误,选项ac正确;
(3)根据反应速率表达式:v(NH3)=2×10-6/(2×3)mol/(L·h)=3.33×10-7mol/(L·h),第四组NH3生成量最小原因可能是:80℃催化剂的催化效率较低,反应速率反而减慢;
(4)①CO2溶于水形成H2CO3,H2CO3是弱酸,电离出的CO32-浓度极少,不会产生沉淀,NH3后,NH3与碳酸电离出的H+发生反应,促使平衡右移,CO32-的浓度增加,有沉淀产生;发生的反应是:2NH3+CO2+H2O=(NH4)2CO3,CaCl2+(NH4)2CO3=CaCO3↓+2NH4Cl,溶质是NH4Cl;②a、c(H+)=c(OH﹣)说明溶液显中性pH=7,根据溶液呈现电中性:c(NH4+)+c(H+)=c(Cl-)+c(OH-),正确;b、根据溶液电中性,此离子浓度大小关系会使溶液带电,错误;c、NH3·H2O![]() NH4++OH-,NH4Cl=NH4++Cl-,氨水的量较大,c(NH4+)>c(OH-)>c(Cl-)>c(H+),正确;d、此离子浓度大小关系不会出现,错误,因此选项ac正确。
NH4++OH-,NH4Cl=NH4++Cl-,氨水的量较大,c(NH4+)>c(OH-)>c(Cl-)>c(H+),正确;d、此离子浓度大小关系不会出现,错误,因此选项ac正确。

【题目】由下列实验及现象推出的相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 2 mL0.01mol·L-1的KI溶液中滴入等体积等浓度的FeCl3溶液,将充分反应后的溶液分三份,一份滴入K3[Fe(CN)6]溶液,第二份滴入KSCN溶液,第三份滴入淀粉溶液 | 滴入K3[Fe(CN)6]溶液后产生蓝色沉淀;滴入KSCN溶夜后变血红色;滴入淀粉溶液后溶液变蓝 | KI溶液和FeCl3溶液发生反应:2Fe3++2I- |
B | 向稀硫酸中加入铜片,然后通入氧气加热 | 先无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸>Cu2+ |
C | 向浓度均为0.1 mol·L-1的Na2SO3和Na2SiO3溶液中分别滴加酚酞 | Na2SiO3溶液红色更深 | 非金属性:Si<S |
D | 将几滴等浓度的FeCl3溶液、AlCl3溶液同时滴入足量等浓度的NaOH溶液中 | 只产生红褐色沉淀 | Ksp[Al(OH)3]>K sp[Fe(OH)3] |
A. A B. B C. C D. D